题目内容
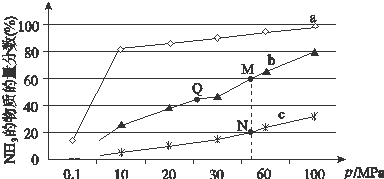
13.下列物质之间有如下反应关系: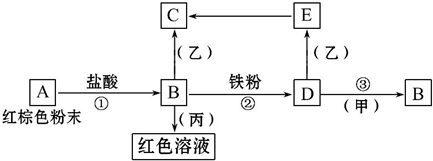
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色.回答:
(1)写出下列物质的化学式:AFe2O3,BFeCl3,乙NaOH,丙KSCN.
(2)写出E→C反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)写出D→B反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
分析 E转化成C的现象是灰白色沉淀迅速变为灰绿色,最后变为红褐色,则E是Fe(OH)2、C是Fe(OH)3,A是红棕色粉末,能和盐酸反应生成B,则A是Fe2O3、B是FeCl3,B和丙反应生成红色溶液,则丙是KSCN,B和Fe反应生成D,则D是FeCl2,D和乙反应生成Fe(OH)2,则乙是NaOH溶液,D和甲反应生成FeCl3,则甲是Cl2,再结合题目分析解答.
解答 解:E转化成C的现象是灰白色沉淀迅速变为灰绿色,最后变为红褐色,则E是Fe(OH)2、C是Fe(OH)3,A是红棕色粉末,能和盐酸反应生成B,则A是Fe2O3、B是FeCl3,B和丙反应生成红色溶液,则丙是KSCN,B和Fe反应生成D,则D是FeCl2,D和乙反应生成Fe(OH)2,则乙是NaOH溶液,D和甲反应生成FeCl3,则甲是Cl2,
(1)通过以上分析知,A、B、乙、丙分别是Fe2O3、FeCl3、NaOH、KSCN,
故答案为:Fe2O3;FeCl3;NaOH;KSCN;
(2)E→C反应是氢氧化亚铁被氧气氧化生成氢氧化铁,反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)D→B反应是氯气氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-.
点评 本题以Fe及其化合物为载体考查无机物推断,以E生成C颜色变化为题眼采用正逆结合的方法进行推断,知道铁离子、亚铁离子检验方法及现象,知道离子方程式书写规则即物质性质即可解答,题目难度中等.

练习册系列答案
相关题目
3.在下列反应中,氧化剂和还原剂为同一种物质的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | MnO2+4HCl(浓)═MnCl2+2H2O+Cl2↑ | ||
| C. | Na2CO3+CO2+H2O═2NaHCO3 | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
4.下列反应的离子方程式中正确的是( )
| A. | 向等物质的量浓度的NaOH和Na2CO3的混合液中加入一定量的稀盐酸:2OH-+CO32-+4H+═CO2↑+2H2O | |
| B. | Ca(HCO3)2溶液中滴加少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 向Fe(OH)2中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 向AlCl3溶液中滴加过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
18.二氧化硫能够使品红溶液褪色,表现了二氧化硫的( )
| A. | 氧化性 | B. | 还原性 | ||
| C. | 漂白性 | D. | 酸性氧化物的性质 |
5.下列离子方程式书写正确的是( )
| A. | 氯化钙溶液中通入CO2气体 Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 以石墨作电极电解氯化铝溶液:2Cl${\;}^{_}$+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | Ca(ClO)2溶液中通人过量的SO2气体:Cl-+SO2+H2O═HClO+HSO${\;}_{3}^{-}$ | |
| D. | 向明矾溶液中加入氢氧化钡溶液至沉淀的质量最大:Al3++2SO${\;}_{4}^{2-}$+2Ba2++4OH-═2BaSO4+AlO${\;}_{2}^{-}$+H2O |
2.短周期元素甲、乙、丙、丁的原子序数依次增大.甲的最高价氧化物与乙的氢化物同时通入水中,得到的生成物既可与酸反应又可与碱反应.丙位于ⅠA族,丁原子的核外电子总数是其最外层电子数的3倍.下列说法中正确的是( )
| A. | 气态氢化物的稳定性:乙<丁 | |
| B. | 原子半径:甲<乙 | |
| C. | 丙的两种氧化物都是离子化合物 | |
| D. | 甲、乙、丁的最高价氧化物对应的水化物的酸性依次增强 |