题目内容
4.学习化学时会遇到很多“相等”,下列有关“相等”的说法中错误的是( )| A. | 原子中核内质子数和核外电子数一定相等 | |
| B. | 溶液稀释前后溶质的质量一定相等 | |
| C. | 常温常压下,酸碱中和反应生成1mol液态水时放出的热量一定相等 | |
| D. | 物质发生化学变化前后,元素的种类一定相等 |
分析 A、原子呈中性;
B、稀释过程中溶质的质量不变;
C、根据中和热的概念分析;
D、根据质量守恒定律分析解答.
解答 解:A、原子中核内质子数和核外电子数一定相等,故A正确;
B、溶液稀释前后溶质的质量一定相等,故B正确;
C、中和热是在稀溶液中强酸与强碱发生中和反应生成1mol水时所释放的热量,这时放出的热量才相等,弱酸弱碱电离要吸热,而浓酸浓碱溶解要发热,故C错误;
D、根据质量守恒定律可知物质发生化学变化前后,元素的种类一定相等,故D正确.
故选C.
点评 本题主要考查了原子的构成,中和反应的概念,质量守恒定律和溶液稀释问题,注意知识的归纳和应用是关键,难度不大.

练习册系列答案
相关题目
19.光纤通信的光学纤维是由下列哪种物质经特殊工艺制成的( )
| A. | 碳 | B. | 二氧化硅 | C. | 铜 | D. | 硅 |
16.钛和钛合金在航空工业有重要应用.冶炼钛的过程中发生的反应之一为TiO2+2C+2Cl2═TiCl4+2CO.对此,下列说法错误的是( )
| A. | C是还原剂 | |
| B. | TiO2是氧化剂 | |
| C. | 生成1 mol TiCl4时,转移电子4 mol | |
| D. | 尾气必须净化处理 |
13.常温下、0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后(假设混合液体积为二者之和),所得溶液中部分微粒组分及浓度如图所示,下列说法不正确的是( )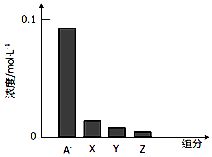

| A. | HA是弱酸 | B. | 该混合液pH>7 | ||
| C. | 该混合溶液中:c(A-)+c(Y)=c(Na+) | D. | 图中X表示HA,Y表示OH-,Z表示H+ |
14.A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如图,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素.
(1)C在元素周期表中的位置为第二周期第ⅥA族,其离子的结构示意图为 .
.
(2)AE2的分子式为CS2.
(3)C、E、F的单质沸点最低的是O2(填化学式).
(4)C、D、E、F的离子半径由大到小的顺序是S2->Cl->O2->Al3+(填离子符号).
(5)实验室制取F2气体的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O.
| A | ||
| E |
 .
.(2)AE2的分子式为CS2.
(3)C、E、F的单质沸点最低的是O2(填化学式).
(4)C、D、E、F的离子半径由大到小的顺序是S2->Cl->O2->Al3+(填离子符号).
(5)实验室制取F2气体的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O.

 (其中:-X、-Y均为官能团
(其中:-X、-Y均为官能团 .
.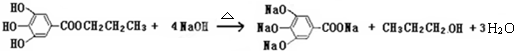
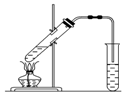 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.