题目内容
向四只盛有一定量NaOH 溶液的烧杯中通入不同量的CO2 气体后,在所得溶液中逐滴加入盐酸至过量,并将溶液加热,产生的气体与加入盐酸的物质的量的关系如图,则下列分析都正确的组合是( )


| 溶质的成份 | 对应的图象 | 原溶液中离子浓度关系 | |
| A | NaHCO3 | Ⅰ | c(Na+)=c(HCO3-) |
| B | NaHCO3、Na2CO3 | Ⅱ | c(CO32-)<c(HCO3-) |
| C | NaOH、Na2CO3 | Ⅲ | c(OH-)>c(CO32-) |
| D | Na2CO3 | Ⅳ | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| A、Ⅰ | B、Ⅱ | C、Ⅲ | D、Ⅳ |
考点:有关混合物反应的计算,钠的重要化合物
专题:
分析:向一定量NaOH溶液的烧杯中通入不同量的CO2气体,可能发生反应:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,
当n(CO2):n(NaOH)<1:2时,溶液中溶质为NaOH、Na2CO3,
当n(CO2):n(NaOH)=1:2时,溶液中溶质为Na2CO3,
当1:2<n(CO2):n(NaOH)<1:1时,溶液中溶质为NaHCO3、Na2CO3,
当n(CO2):n(NaOH)≥1:1时,溶液中溶质为NaHCO3,
假设反应后的溶液中只有Na2CO3,再逐滴加入盐酸,开始发生反应:Na2CO3+2HCl=NaCl+NaHCO3,然后发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,开始没有气体生成,而后有气体生成,前后两阶段消耗盐酸体积相等,
图Ⅰ中加入盐酸立即产生气体,溶液中溶质为NaHCO3,
图Ⅱ中产生气体消耗盐酸体积多,故溶液中溶质为NaHCO3、Na2CO3,前后消耗盐酸体积之比为1:2,故NaHCO3、Na2CO3 物质的量之比为1:1,
图Ⅲ中产生前后两阶段消耗盐酸相等,故溶液中溶质为Na2CO3,
图Ⅳ中产生气体消耗盐酸体积较少,故溶液中溶质为NaOH、Na2CO3,前后消耗盐酸体积之比为2:1,故NaOH、Na2CO3 的物质的量之比为1:1.
当n(CO2):n(NaOH)<1:2时,溶液中溶质为NaOH、Na2CO3,
当n(CO2):n(NaOH)=1:2时,溶液中溶质为Na2CO3,
当1:2<n(CO2):n(NaOH)<1:1时,溶液中溶质为NaHCO3、Na2CO3,
当n(CO2):n(NaOH)≥1:1时,溶液中溶质为NaHCO3,
假设反应后的溶液中只有Na2CO3,再逐滴加入盐酸,开始发生反应:Na2CO3+2HCl=NaCl+NaHCO3,然后发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,开始没有气体生成,而后有气体生成,前后两阶段消耗盐酸体积相等,
图Ⅰ中加入盐酸立即产生气体,溶液中溶质为NaHCO3,
图Ⅱ中产生气体消耗盐酸体积多,故溶液中溶质为NaHCO3、Na2CO3,前后消耗盐酸体积之比为1:2,故NaHCO3、Na2CO3 物质的量之比为1:1,
图Ⅲ中产生前后两阶段消耗盐酸相等,故溶液中溶质为Na2CO3,
图Ⅳ中产生气体消耗盐酸体积较少,故溶液中溶质为NaOH、Na2CO3,前后消耗盐酸体积之比为2:1,故NaOH、Na2CO3 的物质的量之比为1:1.
解答:
解:向一定量NaOH溶液的烧杯中通入不同量的CO2气体,可能发生反应:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,
当n(CO2):n(NaOH)<1:2时,溶液中溶质为NaOH、Na2CO3,
当n(CO2):n(NaOH)=1:2时,溶液中溶质为Na2CO3,
当1:2<n(CO2):n(NaOH)<1:1时,溶液中溶质为NaHCO3、Na2CO3,
当n(CO2):n(NaOH)≥1:1时,溶液中溶质为NaHCO3,
假设反应后的溶液中只有Na2CO3,再逐滴加入盐酸,开始发生反应:Na2CO3+2HCl=NaCl+NaHCO3,然后发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,开始没有气体生成,而后有气体生成,前后两阶段消耗盐酸体积相等,
A.图Ⅰ中加入盐酸立即产生气体,溶液中溶质为NaHCO3,溶液中HCO3-水解,故c(Na+)>c(HCO3-),故A错误;
B.图Ⅱ中产生气体消耗盐酸体积多,故溶液中溶质为NaHCO3、Na2CO3,前后消耗盐酸体积之比为1:2,故NaHCO3、Na2CO3 物质的量之比为1:1,碳酸根的水解程度较大,故c(CO32-)<c(HCO3-),故B正确;
C.图Ⅲ中产生前后两阶段消耗盐酸相等,故溶液中溶质为Na2CO3,故C错误;
D.图Ⅳ中产生气体消耗盐酸体积较少,故溶液中溶质为NaOH、Na2CO3,故D错误,
故选B.
当n(CO2):n(NaOH)<1:2时,溶液中溶质为NaOH、Na2CO3,
当n(CO2):n(NaOH)=1:2时,溶液中溶质为Na2CO3,
当1:2<n(CO2):n(NaOH)<1:1时,溶液中溶质为NaHCO3、Na2CO3,
当n(CO2):n(NaOH)≥1:1时,溶液中溶质为NaHCO3,
假设反应后的溶液中只有Na2CO3,再逐滴加入盐酸,开始发生反应:Na2CO3+2HCl=NaCl+NaHCO3,然后发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,开始没有气体生成,而后有气体生成,前后两阶段消耗盐酸体积相等,
A.图Ⅰ中加入盐酸立即产生气体,溶液中溶质为NaHCO3,溶液中HCO3-水解,故c(Na+)>c(HCO3-),故A错误;
B.图Ⅱ中产生气体消耗盐酸体积多,故溶液中溶质为NaHCO3、Na2CO3,前后消耗盐酸体积之比为1:2,故NaHCO3、Na2CO3 物质的量之比为1:1,碳酸根的水解程度较大,故c(CO32-)<c(HCO3-),故B正确;
C.图Ⅲ中产生前后两阶段消耗盐酸相等,故溶液中溶质为Na2CO3,故C错误;
D.图Ⅳ中产生气体消耗盐酸体积较少,故溶液中溶质为NaOH、Na2CO3,故D错误,
故选B.
点评:本题考查化学图象计算、混合物计算、离子浓度比较等,根据反应消耗盐酸的体积判断溶液中溶质是关键,难度中等.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
在一定条件下,红棕色的NO2可发生如下的反应:2NO2(g)?2NO(g)+O2(g)△H>0.下列叙述正确的是( )
| A、恒温恒容,充入NO2气体,其转化率增大 |
| B、加压(通过缩小容器体积)平衡向逆反应方向移动混合气体颜色加深 |
| C、若平衡常数增大,则可能是升高温度或减小了体系压强 |
| D、当2v正(NO)═v逆(O2)时,反应达到化学平衡 |
现有四种试剂:①新制氢氧化铜悬浊液;②浓硝酸;③硝酸银溶液;④碘水.为了鉴别葡萄糖、淀粉、食盐、鸡蛋清(主要成分是蛋白质)四瓶无色溶液,分别选择合适的试剂,正确的答案是( )
| A、①②③④ | B、④①②③ |
| C、①④②③ | D、①④③② |
由三种金属组成的混合物12g,投入足量的稀硫酸中完全反应后产生H2 11.2L(标准状况),此混合物可能是( )
| A、Fe、Mg、Ag |
| B、Fe、Al、Mg |
| C、Zn、Fe、Mg |
| D、Fe、Mg、Cu |
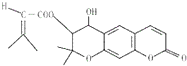 紫花前胡丙素具有祛谈解痉,抗血小板聚集、抑制癌细胞的生长等作用,它的结构简式如图,有关紫花前胡丙素的说法正确的是( )
紫花前胡丙素具有祛谈解痉,抗血小板聚集、抑制癌细胞的生长等作用,它的结构简式如图,有关紫花前胡丙素的说法正确的是( )| A、能使溴的四氯化碳溶液褪色 |
| B、1mol紫花前胡丙素最多可与含3molNaOH的溶液完全作用 |
| C、分子中能有原子可以处于同一平面 |
| D、能与氯化铁溶液作用显紫色 |
分子式为C8H10O的同分异构体中,属于芳香醇且其催化氧化产物能发生银镜反应的有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
栀子花的香味沁人心脾,其中一种物质--栀子酯的重要成分是下列说法正确的是( )

| A、该栀子酯的分子式C10H11O2 |
| B、栀子酯的一氯代物有六种 |
| C、栀子酯可以发生加成、取代和消去反应 |
| D、1mol栀子酯水解需要消耗2molNaOH |
如图是部分短周期元素最外层电子数与原子序数的关系图,下列说法正确的是( )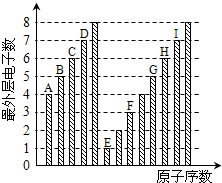

| A、原子半径:A<B<C<D |
| B、E和C元素形成的化合物中只可能存在离子键 |
| C、气态氢化物稳定性:I>D>H>G |
| D、E、F和H三种元素相应的最高价氧化物对应水化物之间两两会发生反应 |
