题目内容
由三种金属组成的混合物12g,投入足量的稀硫酸中完全反应后产生H2 11.2L(标准状况),此混合物可能是( )
| A、Fe、Mg、Ag |
| B、Fe、Al、Mg |
| C、Zn、Fe、Mg |
| D、Fe、Mg、Cu |
考点:有关混合物反应的计算
专题:平均值法
分析:假设金属均为+2价,金属总物质的量等于氢气物质的量,计算金属平均摩尔质量,因为为两种金属的混合物,故平均摩尔质量应介于各组分之间,根据电子转移守恒,若金属不与盐酸反应,其摩尔质量可以视作无穷大;当Al的化合价为+2价时,可看成其相对原子质量为:
×27=18.
| 2 |
| 3 |
解答:
解:标准状况下11.2L氢气的物质的量为
=0.5mol,假设金属都为+2价,根据电子转移守恒可知,金属的物质的量为0.5mol,则金属混合物的平均摩尔质量为
=24g/mol,
A.Fe的相对原子质量为56,Mg的相对原子质量为24,Ag不与稀硫酸反应,则混合金属的平均摩尔质量一定大于24g/mol,故A错误;
B.Fe的相对原子质量为56,当Al的化合价为+2价时,可看成其相对原子质量为
×27=18,Mg的相对原子质量为24,混合金属的平均摩尔质量可以为24,故B正确;
C.Zn的相对原子质量为65,Fe的相对原子质量为56,Mg的相对原子质量为24,混合金属的平均摩尔质量一定大于24g/mol,故C错误;
D.Fe的相对原子质量为56,Mg的相对原子质量为24,Cu不与稀硫酸反应,则混合金属的平均摩尔质量一定大于24g/mol,故D错误;
故选B.
| 11.2L |
| 22.4L/mol |
| 12g |
| 0.5mol |
A.Fe的相对原子质量为56,Mg的相对原子质量为24,Ag不与稀硫酸反应,则混合金属的平均摩尔质量一定大于24g/mol,故A错误;
B.Fe的相对原子质量为56,当Al的化合价为+2价时,可看成其相对原子质量为
| 2 |
| 3 |
C.Zn的相对原子质量为65,Fe的相对原子质量为56,Mg的相对原子质量为24,混合金属的平均摩尔质量一定大于24g/mol,故C错误;
D.Fe的相对原子质量为56,Mg的相对原子质量为24,Cu不与稀硫酸反应,则混合金属的平均摩尔质量一定大于24g/mol,故D错误;
故选B.
点评:本题考查了金属混合物与酸反应的计算,题目难度中等,注意掌握平均摩尔质量在化学计算中的应用方法,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,用图所示装置探究废旧塑料的再利用.下列叙述不正确的是( )
加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,用图所示装置探究废旧塑料的再利用.下列叙述不正确的是( )| A、丙烯分子中共用电子对数为10 |
| B、装置B的试管中可收集到芳香烃 |
| C、装置C中的试剂可吸收烯烃以制取卤代烃 |
| D、最后收集的气体可做燃料 |
《中华人民共和国食品安全法》于2009年6月1日起实施,下列说法不利于食品安全的是( )
| A、在食盐中添加适量的碘酸钾 |
| B、在食品加工中严格按照剂量标准科学使用食品添加剂 |
| C、研发高效低毒的农药,降低蔬菜的农药残留量 |
| D、用聚氯乙烯塑料袋包装食品 |
下列生活中的化学的说法,不正确的是( )
| A、用热的纯碱可除去炊具上的油污 |
| B、福尔马林可制备标本是利用了使蛋白质变性的性质 |
| C、含钙、钡等金属元素的物质有绚丽的颜色,可用于制造焰火 |
| D、红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
下列有关生活中常见有机物的说法正确的是( )
| A、甲烷和氯气在光照条件下发生取代反应,产物是气体与液体的混合物 |
| B、液化石油气和天然气的主要成分都是甲烷 |
| C、苯和乙烯都能使溴水层变为无色,二者都发生加成反应 |
| D、煤干馏可得煤油,甲烷、乙烯和苯都能从石油中分馏得到 |
按图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )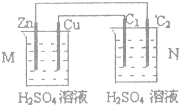

| A、C1上发生还原反应 |
| B、M装置中SO2-4移向Cu电极 |
| C、工作一段时间后装置M中溶液PH变大,装置N中溶液PH变小 |
| D、Cu电极与C2电极上的电极反应不同 |