题目内容
在一定条件下,红棕色的NO2可发生如下的反应:2NO2(g)?2NO(g)+O2(g)△H>0.下列叙述正确的是( )
| A、恒温恒容,充入NO2气体,其转化率增大 |
| B、加压(通过缩小容器体积)平衡向逆反应方向移动混合气体颜色加深 |
| C、若平衡常数增大,则可能是升高温度或减小了体系压强 |
| D、当2v正(NO)═v逆(O2)时,反应达到化学平衡 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、利用等效平衡分析;
B、容器体积减小,平衡向体积减小的方向移动,混合气体的颜色与NO2的浓度成比例,据此判断;
C、根据影响平衡常数的因素判断;
D、根据速率之比等于计量数之比判断.
B、容器体积减小,平衡向体积减小的方向移动,混合气体的颜色与NO2的浓度成比例,据此判断;
C、根据影响平衡常数的因素判断;
D、根据速率之比等于计量数之比判断.
解答:
解:A、假设将充入的NO2气体放在另一个容器中建立与原平衡为等效平衡的体系,再将该体系加入到原平衡体系中,容器体积不变是,相当于加压,平衡逆向移动,NO2气体的转化率减小,故A错误;
B、因为该反应是体积增大的反应,容器体积减小,平衡逆向移动,NO2的浓度增大,体积减小,所有物质的浓度也都会增大,所以混合气体的颜色会加深,故B正确;
C、平衡常数只受温度影响,与压强无关,故C错误;
D、当v正(NO)═2v逆(O2),反应达到化学平衡时,故D错误;
故选B.
B、因为该反应是体积增大的反应,容器体积减小,平衡逆向移动,NO2的浓度增大,体积减小,所有物质的浓度也都会增大,所以混合气体的颜色会加深,故B正确;
C、平衡常数只受温度影响,与压强无关,故C错误;
D、当v正(NO)═2v逆(O2),反应达到化学平衡时,故D错误;
故选B.
点评:本题主要考查了影响化学平衡移动的因素、等效平衡的思想、影响平衡常数的因素及平衡状态的判断等知识点,中等难度,解题时注意化学原理知识的灵活运用.

练习册系列答案
相关题目
下列实验方案能够达到预期目的是( )
| A、区别苯和乙苯:加酸性高锰酸钾溶液,振荡,观察现象 |
| B、检验无水乙醇中是否含有少量水:加硫酸铜晶体观察现象 |
| C、乙醇的消去反应、皂化反应、淀粉的水解反应均可用浓硫酸作催化剂 |
| D、检验氯代烃中的氯元素时,可先加氢氧化钠溶液加热,再加入硝酸溶液,最后加入硝酸银溶液来进行检验 |
铝能用来冶炼难熔金属(如Fe、V、Mn等),这是因为铝有( )
| A、两性 |
| B、良好导电性 |
| C、熔点低 |
| D、还原性,在反应中放出大量热 |
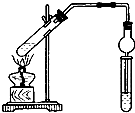 用如图所示实验装置制取乙酸乙酯.回答以下问题:
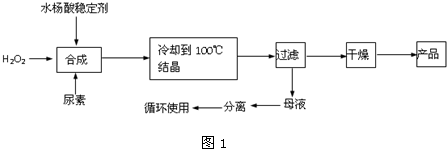
用如图所示实验装置制取乙酸乙酯.回答以下问题: 出发来合成A,其合成路线如图:
出发来合成A,其合成路线如图: