题目内容
A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4.请回答:
①若Y是黄绿色气体,则该反应的离子方程式是 .
②若A、B、X、Y均为化合物.A溶于水电离出的金属阳离子水解的生成物可净化水,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4恰好反应,所得溶液为无色时,该溶液中所有离子浓度从大到小的顺序 .
①若Y是黄绿色气体,则该反应的离子方程式是
②若A、B、X、Y均为化合物.A溶于水电离出的金属阳离子水解的生成物可净化水,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4恰好反应,所得溶液为无色时,该溶液中所有离子浓度从大到小的顺序
考点:无机物的推断
专题:推断题
分析:①若Y是黄绿色气体,则Y为氯气,A、B的物质的量之比为1:4,该反应为二氧化锰与浓盐酸制备氯气;
②B的焰色为黄色,含有Na元素;向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,则A中含有氯离子,A溶于水电离出的金属阳离子水解的生成物可净化水,且A与B按物质的量之比1:4恰好反应,所得溶液为无色,该反应是氯化铝与氢氧化钠反应,所得溶液中溶质为生成物:偏铝酸钠、氯化钠,结合各组分物质的量及偏铝酸根水解判断离子浓度大小.
②B的焰色为黄色,含有Na元素;向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,则A中含有氯离子,A溶于水电离出的金属阳离子水解的生成物可净化水,且A与B按物质的量之比1:4恰好反应,所得溶液为无色,该反应是氯化铝与氢氧化钠反应,所得溶液中溶质为生成物:偏铝酸钠、氯化钠,结合各组分物质的量及偏铝酸根水解判断离子浓度大小.
解答:
解:①若Y是黄绿色气体,则Y为氯气,A、B的物质的量之比为1:4,该反应为二氧化锰与浓盐酸制备氯气,则该反应的离子方程式是:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
②B的焰色为黄色,含有Na元素;向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,则A中含有氯离子,A溶于水电离出的金属阳离子水解的生成物可净化水,且A与B按物质的量之比1:4恰好反应,所得溶液为无色,该反应是氯化铝与氢氧化钠反应,所得溶液中溶质为生成物:偏铝酸钠、氯化钠,
该反应为:AlCl3+4NaOH=3NaCl+NaAlO2+2H2O,显然若A与B的物质的量分别为1mol、4mol,则钠离子4mol,氯离子3mol,偏铝酸根离子略小于1mol,因偏铝酸根离子水解则溶液显碱性,即c(OH-)>c(H+),则离子大小为c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+).
| ||
| ||
②B的焰色为黄色,含有Na元素;向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,则A中含有氯离子,A溶于水电离出的金属阳离子水解的生成物可净化水,且A与B按物质的量之比1:4恰好反应,所得溶液为无色,该反应是氯化铝与氢氧化钠反应,所得溶液中溶质为生成物:偏铝酸钠、氯化钠,
该反应为:AlCl3+4NaOH=3NaCl+NaAlO2+2H2O,显然若A与B的物质的量分别为1mol、4mol,则钠离子4mol,氯离子3mol,偏铝酸根离子略小于1mol,因偏铝酸根离子水解则溶液显碱性,即c(OH-)>c(H+),则离子大小为c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+).
点评:本题考查无机物推断,属于开放性题目,需要学生熟练掌握元素化合物知识,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 下表各组物质中,满足如图物质(或其水溶液)一步转化关系的选项是( )
下表各组物质中,满足如图物质(或其水溶液)一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | Na | NaOH | Na2O |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | Cl2 | FeCl2 | FeCl3 |
| D | CO2 | Na2CO3 | NaHCO3 |
| A、A | B、B | C、C | D、D |
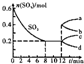 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示.下列判断正确的是( )
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示.下列判断正确的是( )| A、用O2表示0~8 min内该反应的平均速率为0.025 mol?(L?min)-1 |
| B、升高温度,达到新平衡时的化学平衡常数比原平衡的小 |
| C、容器内压强保持不变时反应处于平衡状态 |
| D、第12min时,容器压强到1L,则SO3的变化曲线为a |
将锌片和铜片用导线连接置于稀硫酸溶液中,下列叙述错误的是( )
| A、锌片做负极,锌发生还原反应 |
| B、铜片做正极 |
| C、溶液中的pH值增大 |
| D、溶液中的H+向正极移动 |
下列物质的分子中,属于正四面体结构的是( )
| A、CHCl3 |
| B、CH4 |
| C、CH2Cl2 |
| D、CH3Cl |