题目内容
14.已知X、Y、Z是3种短周期元素.X、Y位于同一主族,Y、Z处于同一周期.X原子的最外层电子数是其电子层数的3倍.Z原子的核外电子数比Y原子少1.下列说法正确的是( )| A. | 元素非金属性由弱到强的顺序为Z<Y<X | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 | |
| C. | 3种元素的气态氢化物中,Z的气态氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为Z>Y>X |
分析 X、Y、Z是3种短周期元素,X原子的最外层电子数是其电子层数的3倍,则X有2个电子层,最外层电子数为6,故X为O元素;X、Y位于同一族,故Y为S元素;Y、Z处于同一周期,Z原子的核外电子数比Y少1,则Z原子的核外电子数为15,故Z为P元素,结合元素周期律解答.
解答 解:X、Y、Z是3种短周期元素,X原子的最外层电子数是其电子层数的3倍,则X有2个电子层,最外层电子数为6,故X为O元素;X、Y位于同一族,故Y为S元素;Y、Z处于同一周期,Z原子的核外电子数比Y少1,则Z原子的核外电子数为15,故Z为P元素,
A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,所以非金属性P<S<O,即Z<Y<X,故A正确;
B.Y为硫元素,最高价氧化物对应水化物的化学式可表示为H2SO4,故B错误;
C.非金属性P<S<O,非金属性越强,氢化物越稳定,所以氢化物稳定性Z<Y<X,故C错误;
D.同周期自左而右原子半径减小,同主族自上而下原子半径增大,所以原子半径P>S>O,即Z>Y>X,故D正确,
故选AD.
点评 本题考查原子结构和周期律的应用,为高频考点,把握X原子的最外层电子数是其电子层数的3倍推断X为O元素为解答的关键,侧重分析与应用能力的考查,注意周期律及元素化合物知识运用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.用分液漏斗可以分离的一组混合物是( )
| A. | 氯化钠和水 | B. | 水和酒精 | C. | 苯和水 | D. | 泥沙和水 |
2.在温度不变的条件下,密闭容器中发生如下反应:2SO2(g)+O2(g)?2SO3(g),下列叙述能够说明反应已经达到平衡状态的是( )
| A. | 容器中SO2、O2、SO3共存 | |
| B. | SO2与SO3的浓度保持不变 | |
| C. | 容器中SO2、O2、SO3的物质的量之比为2:1:2 | |
| D. | 反应容器中压强不随时间变化 |
19.下列反应无论怎样调整反应物的用量,都只能生成一种物质的是( )
| A. | 甲烷与氯气混合后在光照的条件下发生反应 | |
| B. | 乙烯与水的加成反应 | |
| C. | 1,3-丁二烯与溴的加成 | |
| D. | 2,3-二溴丁烷的消去反应 |
6.乙醇汽油是用普通汽油与燃料乙醇调和而成,它可以有效改善油的性能和质量,降低一氧化碳、碳氢化合物等主要污染物的排放.1mol乙醇完全燃烧生成液态水和二氧化碳气体放出23.5kJ热量,燃烧1mol这种汽油生成液态水,放出的热量为Q kJ.测得该汽油中乙醇与汽油的物质的量之比为1:9.有关普通汽油(CxHy)燃烧的热化学方程式正确的一项是( )
| A. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-Q+23.5)kJ•mol-1 | |
| B. | CxHy(l)+( x+$\frac{y}{4}$)O2═xCO2+$\frac{y}{2}$H2O(l)△H=?-$\frac{9Q}{10}$?kJ•mol-1 | |
| C. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=-$\frac{9Q}{10}$ kJ•mol-1 | |
| D. | CxHy(l)+( x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+2.61)kJ•mol-1 |
3.下列变化过程中,没有破坏化学键的是( )
| A. | 氧气溶于水 | B. | 碳的燃烧 | C. | 氯气与氢气反应 | D. | 水的通电分解 |


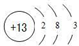 ;B和C形成的化合物的电子式为
;B和C形成的化合物的电子式为 ;
;