题目内容
18.下列盐中,既可以用“碱性氧化物+酸”的方式制取,也可以用“酸性氧化物+碱”的方式制取的是( )| A. | FeCl3 | B. | Na2S | C. | (NH4)2CO3 | D. | Na2SO4 |
分析 A.只能利用氧化铁与酸反应生成;
B.可利用氧化钠与氢硫酸反应;
C.可利用二氧化碳与一水合氨反应生成;
D.可利用氧化钠与硫酸反应或三氧化硫与NaOH反应生成.
解答 解:A.只能利用碱性氧化物与酸反应生成FeCl3,故A不选;
B.只能利用碱性氧化物与酸反应生成Na2S,故B不选;
C.只利用酸性氧化物与碱反应生成(NH4)2CO3,故C不选;
D.氧化钠与硫酸反应或三氧化硫与NaOH反应均生成Na2SO4,故D选;
故选D.
点评 本题考查物质的性质及反应,为高频考点,把握酸、碱、盐之间的关系及相互转化为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
8.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,1mol H2O的体积约为22.4L | |
| B. | 106g Na2CO3含有的Na+离子数为2 NA | |
| C. | 常温常压下,1 NA 个CO2分子占有的体积为22.4L | |
| D. | 1mol任何粒子的粒子数叫做阿伏加德罗常数,通常用6.02×1023表示 |
9.对下列实验的现象和结论的分析正确的是( )
| A. | 某溶液$\stackrel{+石蕊}{→}$溶液呈红色:原溶液是酸溶液 | |
| B. | 某溶液$\stackrel{+盐酸酸化}{→}$无明显现象$\stackrel{+BaCl_{2}溶液}{→}$有白色沉淀:原溶液中含SO42- | |
| C. | 某溶液$\stackrel{+酚酞}{→}$溶液呈红色:原溶液是碱溶液 | |
| D. | 某溶液$\stackrel{+稀硫酸}{→}$生成无色无味气体,说明原溶液中有CO32- |
6.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 盐酸 | B. | 雾 | C. | 氯化钠溶液 | D. | CuSO4溶液 |
13.下列液体均处于25℃,有关叙述中,正确的是( )
| A. | 某溶液中水电离出的c(H+)=10-13,则该溶液的pH一定为13 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 | |
| C. | pH相同的氨水与盐酸等体积混合,所得溶液pH<7 | |
| D. | pH=7的CH3COOH与CH3COONa混合溶液中,c(Na+)=c(CH3COO-) |
3.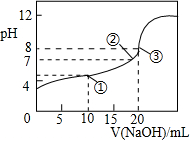 25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
 25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )| A. | ①点时:c(ClO2-)>c(Na+)>c(H+)>c(OH-) | |
| B. | ②点时:c(Na+)=c(ClO2-) | |
| C. | ③点时:c(H+)=c(OH-)+c(HClO2) | |
| D. | 滴定过程中可能出现:c(Na+)>c(ClO2-)>c(OH-)>c(H+) |
18.下列溶液中,微粒浓度关系正确的是( )
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)<c(OH-) | |
| B. | pH=6的醋酸与醋酸钠的混合溶液中,c(Na+)>c(CH3COO-) | |
| C. | 0.1 mol/L 的Na2S溶液中,c(OH)=c(H+)+c(HS-)+2c(H2S) | |
| D. | pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中,一定是c(OH-)=c(H+) |
19.-种制取粗碘的工艺流程如图所示,下列有关说法错误的是( )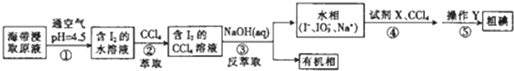

| A. | 步骤②中的萃取过程为物理变化 | |
| B. | 步骤③发生的反应中I2是氧化剂,NaOH是还原剂 | |
| C. | 步骤④所加的试剂X可能是稀硫酸 | |
| D. | 步骤⑤涉及的主要操作Y为分液和蒸馏 |