题目内容
13.标准状况下,8.96L甲烷和一氧化碳混合气体的质量为7.60g,求:(1)甲烷的体积?
(2)一氧化碳的质量为?
(3)此混合气体的平均相对分子质量为?
分析 由平均摩尔质量=$\frac{m}{n}$来计算,由质量和物质的量的关系列方程解出甲烷的物质的量,再计算混合气体中甲烷的体积和一氧化碳的质量.
解答 解:标准状况下,8.96L气体的物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,设甲烷的物质的量为x,CO的物质的量为y,
则$\left\{\begin{array}{l}{x+y=0.4mol}\\{16x+28y=7.6g}\end{array}\right.$,解得x=0.3mol,y=0.1mol,
(1)混合气体中甲烷的体积为0.3mol×22.4mol/L=6.72L,
答:甲烷的体积为6.72L;
(2)一氧化碳的质量为:0.1mol×28g/mol=2.8g,
答:一氧化碳的质量为2.8g;
(3)合气体平均摩尔质量为$\frac{7.6g}{0.4mol}$=19g/mol,
答:混合气体的相对分子质量为19.
点评 本题综合考查物质的量的计算,侧重于学生的计算能力的考查,注意把握相关计算公式列式解答该题,难度不大.

练习册系列答案
相关题目
4.下列化学式只表示一种纯净物的是( )
| A. | C4H8 | B. | C4H10 | C. | C5H12 | D. | C2H4 |
1.已知下列几种烷烃的燃烧热数据如下:
据此判断,表示戊烷燃烧的热化学方程式正确的是( )
| 烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 |
| 燃烧热/(kJ/mol-1) | 890 | 1560 | 2220 | 2880 |
| A. | C5H12(l)+8O2(g)=5CO2(g)+6H2O (l);△H=-3540 kJ/mol | |
| B. | C5H12(l)+8O2(g)=5CO2(g)+6H2O(g);△H=-3540 kJ/mol | |
| C. | C5H12(l)+8O2(g)=5CO2(g)+6H2O(g);△H=+3540 kJ/mol | |
| D. | C5H12(l)+8O2(g)=5CO2(g)+6H2O(l);△H=+3540 kJ/mol |
15.下列化学用语正确的是( )
| A. | HClO的电子式: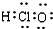 | B. | 中子数为10的氧原子:${\;}_{8}^{18}$O | ||
| C. | 乙烯的结构简式 CH2CH2 | D. | CH4分子的球棍模型: |
 中填上所需的微粒。
中填上所需的微粒。