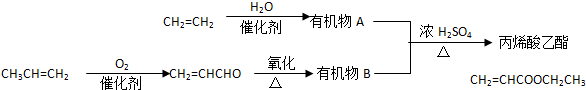
题目内容
某氧化铁样品中含有少量的杂质FeSO4.某实验小组同学要测定其中铁元素的质量分数,他们设计了如下方案进行测定,操作流程为:

请根据流程回答:
(1)加入过量的稀硫酸,发生反应的离子方程式 ;
(2)操作II中量取25.00mL液体需要使用的仪器是 ;
(3)反应①中,加入足量H2O2溶液的目的是 ;
(4)如何检验加入过氧化氢后,溶液中只有Fe3+而没有Fe2+, ;
(5)检验沉淀是否冼涤干净的操作 ;
(6)沉淀需在坩埚中灼烧,取用坩埚需用 (填仪器名称),将沉淀物加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为blg,再次加热并冷却至室温称量其质量为b2 g,如果bl-b2的差值 就不需再加热,否则还要加热称量.
(7)若坩埚的质量为42.6g,最终坩埚与加热后固体的总质量为47.0g,则样品中铁元素的质量分数= (保留一位小数).

请根据流程回答:
(1)加入过量的稀硫酸,发生反应的离子方程式
(2)操作II中量取25.00mL液体需要使用的仪器是
(3)反应①中,加入足量H2O2溶液的目的是
(4)如何检验加入过氧化氢后,溶液中只有Fe3+而没有Fe2+,
(5)检验沉淀是否冼涤干净的操作
(6)沉淀需在坩埚中灼烧,取用坩埚需用
(7)若坩埚的质量为42.6g,最终坩埚与加热后固体的总质量为47.0g,则样品中铁元素的质量分数=
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:氧化铁样品中含有少量的杂质FeSO4,加入过量稀硫酸和水溶解反应得到硫酸铁和硫酸亚铁混合溶液,配制250.00ml溶液,用滴定管量取25ml溶液加入过氧化氢氧化亚铁离子,加入过量氨水沉淀铁离子,过滤洗涤得到氢氧化铁沉淀,灼烧得到红棕色固体为氧化铁;
(1)氧化铁与稀硫酸反应生成硫酸铁和水;
(2)量筒的精确度一般为0.1mL,滴定管的精确度一般为0.01mL,量取25.00mL酸性溶液应该选择25mL酸式滴定管;
(3)双氧水是常用绿色氧化剂,其目的是将硫酸亚铁氧化为硫酸铁;
(4)取少量加入过氧化氢后的液体,加入KSCN,溶液变红,则含有Fe3+,再取少量液体加入MnO2,有气体放出,则H2O2过量,没有Fe2+;
(5)H++NH3?H2O=H2O+NH4+、Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,Fe(OH)3沉淀表面吸附着可溶性的硫酸铵、氨水,用可溶性钡盐溶液检验SO42-是否洗涤干净;
(6)取用坩埚需要坩埚钳,2Fe(OH)3
Fe2O3+3H2O,若b1、b2几乎相等即bl-b2≤0.1g,说明Fe(OH)3沉淀几乎完全分解为Fe2O3固体,若b1-b2>0.1,说明Fe(OH)3沉淀没有彻底分解,因此需要对盛有Fe(OH)3沉淀的坩埚进行多次加热、在干燥器中冷却、称量并记录质量,直至称量质量几乎相等;
(7)先求氧化铁的质量,m(Fe2O3)=47.0g-42.6g=4.4g;再求铁元素的质量,m(Fe)=m(Fe2O3)×
=(47.0g-42.6g)×
=3.08g;
根据铁元素质量守恒可知,25.00mL待测液中m(Fe)=3.08g,则250.00mL待测液中m(Fe)=(47.0g-42.6g)×
×
;
根据铁元素质量守恒可知,28.0g样品中m(Fe)=(44.8g-42.6g)×
×
=30.8g;
最后求样品中铁元素的质量分数.
(1)氧化铁与稀硫酸反应生成硫酸铁和水;
(2)量筒的精确度一般为0.1mL,滴定管的精确度一般为0.01mL,量取25.00mL酸性溶液应该选择25mL酸式滴定管;
(3)双氧水是常用绿色氧化剂,其目的是将硫酸亚铁氧化为硫酸铁;
(4)取少量加入过氧化氢后的液体,加入KSCN,溶液变红,则含有Fe3+,再取少量液体加入MnO2,有气体放出,则H2O2过量,没有Fe2+;
(5)H++NH3?H2O=H2O+NH4+、Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,Fe(OH)3沉淀表面吸附着可溶性的硫酸铵、氨水,用可溶性钡盐溶液检验SO42-是否洗涤干净;
(6)取用坩埚需要坩埚钳,2Fe(OH)3
| ||
(7)先求氧化铁的质量,m(Fe2O3)=47.0g-42.6g=4.4g;再求铁元素的质量,m(Fe)=m(Fe2O3)×
| 112g |
| 160g/mol |
| 112g |
| 160g/mol |
根据铁元素质量守恒可知,25.00mL待测液中m(Fe)=3.08g,则250.00mL待测液中m(Fe)=(47.0g-42.6g)×
| 112g |
| 160g/mol |
| 250 |
| 25 |
根据铁元素质量守恒可知,28.0g样品中m(Fe)=(44.8g-42.6g)×
| 112g |
| 160g/mol |
| 500 |
| 50 |
最后求样品中铁元素的质量分数.
解答:
解:(1)氧化铁与稀硫酸反应的离子方程式:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)量筒的精确度一般为0.1mL,滴定管的精确度一般为0.01mL,Fe2O3+3H2SO4(过量)=Fe2(SO4)3+3H2O,硫酸铁、硫酸亚铁和硫酸的混合溶液显酸性,量取25.00mL酸性溶液应该选择25mL酸式滴定管,故答案为:25.00mL酸式滴定管;
(3)双氧水是常用绿色氧化剂,其目的是将硫酸亚铁氧化为硫酸铁,故答案为:将Fe2+全部氧化为Fe3+;
(4)取少量加入过氧化氢后的液体,加入KSCN,溶液变红,则含有Fe3+,再取少量液体加入MnO2,有气体放出,则H2O2过量,没有Fe2+;
故答案为:取少量加入过氧化氢后的液体,加入KSCN,溶液变红,则含有Fe3+,再取少量液体加入MnO2,有气体放出,则H2O2过量,没有Fe2+;
(5)H++NH3?H2O=H2O+NH4+、Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,Fe(OH)3沉淀表面吸附着可溶性的硫酸铵、氨水,由于SO42-+Ba2+=BaSO4↓,因此常用可溶性钡盐溶液检验SO42-是否洗涤干净,步骤为:取少量最后一次洗涤液于试管中,加入Ba(NO3)2(或BaCl2)溶液,若无白色沉淀,则沉淀洗净;
故答案为:取少量最后一次洗涤液于试管中,加入Ba(NO3)2(或BaCl2)溶液,若无白色沉淀,则沉淀洗净
(6)取用坩埚需要坩埚钳,2Fe(OH)3
Fe2O3+3H2O,若b1、b2几乎相等即bl-b2≤0.1g,说明Fe(OH)3沉淀几乎完全分解为Fe2O3固体,若b1-b2>0.1,说明Fe(OH)3沉淀没有彻底分解,因此需要对盛有Fe(OH)3沉淀的坩埚进行多次加热、在干燥器中冷却、称量并记录质量,直至称量质量几乎相等;
故答案为:坩埚钳;≤0.1g;
(7)先求氧化铁的质量,m(Fe2O3)=47.0g-42.6g=4.4g;再求铁元素的质量,m(Fe)=m(Fe2O3)×
=(47.0g-42.6g)×
=3.08g;
根据铁元素质量守恒可知,25.00mL待测液中m(Fe)=3.08g,则250.00mL待测液中m(Fe)=(47.0g-42.6g)×
×
;
根据铁元素质量守恒可知,28.0g样品中m(Fe)=(44.8g-42.6g)×
×
=30.8g;
w(Fe)=
×100%=
×100%=55.0%,
故答案为:55.0%.
(2)量筒的精确度一般为0.1mL,滴定管的精确度一般为0.01mL,Fe2O3+3H2SO4(过量)=Fe2(SO4)3+3H2O,硫酸铁、硫酸亚铁和硫酸的混合溶液显酸性,量取25.00mL酸性溶液应该选择25mL酸式滴定管,故答案为:25.00mL酸式滴定管;
(3)双氧水是常用绿色氧化剂,其目的是将硫酸亚铁氧化为硫酸铁,故答案为:将Fe2+全部氧化为Fe3+;
(4)取少量加入过氧化氢后的液体,加入KSCN,溶液变红,则含有Fe3+,再取少量液体加入MnO2,有气体放出,则H2O2过量,没有Fe2+;
故答案为:取少量加入过氧化氢后的液体,加入KSCN,溶液变红,则含有Fe3+,再取少量液体加入MnO2,有气体放出,则H2O2过量,没有Fe2+;
(5)H++NH3?H2O=H2O+NH4+、Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,Fe(OH)3沉淀表面吸附着可溶性的硫酸铵、氨水,由于SO42-+Ba2+=BaSO4↓,因此常用可溶性钡盐溶液检验SO42-是否洗涤干净,步骤为:取少量最后一次洗涤液于试管中,加入Ba(NO3)2(或BaCl2)溶液,若无白色沉淀,则沉淀洗净;
故答案为:取少量最后一次洗涤液于试管中,加入Ba(NO3)2(或BaCl2)溶液,若无白色沉淀,则沉淀洗净
(6)取用坩埚需要坩埚钳,2Fe(OH)3
| ||
故答案为:坩埚钳;≤0.1g;
(7)先求氧化铁的质量,m(Fe2O3)=47.0g-42.6g=4.4g;再求铁元素的质量,m(Fe)=m(Fe2O3)×
| 112g |
| 160g/mol |
| 112g |
| 160g/mol |
根据铁元素质量守恒可知,25.00mL待测液中m(Fe)=3.08g,则250.00mL待测液中m(Fe)=(47.0g-42.6g)×
| 112g |
| 160g/mol |
| 250 |
| 25 |
根据铁元素质量守恒可知,28.0g样品中m(Fe)=(44.8g-42.6g)×
| 112g |
| 160g/mol |
| 500 |
| 50 |
w(Fe)=
| m(Fe) |
| m(样品) |
| 30.8g |
| 56.0g |
故答案为:55.0%.
点评:本题考查了物质组成的分析判断,实验探究方法和实验过程分析,元素守恒的计算应用,误差分析和量具的精确度理解,掌握基础是关键,题目难度中等.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案
相关题目
结合如图判断,下列叙述正确的是( )


| A、Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| B、Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C、Ⅰ和Ⅱ中正极均被保护 |
| D、Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
利用下列实验装置及药品(依次为①-④)能完成相应实验的是( )
A、 实验测定化学反应速率 |
B、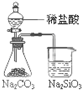 能证明非金属性 Cl>C>Si |
C、 实验制取并收集NH3 |
D、 滴定法测定盐酸浓度 |