题目内容
1.一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4•H2O是一种重要的染料及农药中间体.某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为图1:
相关信息如下以下电离(解离)过程:
①[Cu(NH3)4]SO4•H2O=[Cu(NH3)4]2++SO42-+H2O
[Cu(NH3)4]2+?Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶.
③[Cu(NH3)4]SO4•H2O在乙醇•水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图2:

请根据以下信息回答下列问题:
(1)方案1的实验步骤为:a.加热蒸发 b.冷却结晶 c.抽滤 d.洗涤 e.干燥
①骤1的抽滤装置如图3所示,该装置中的错误之处是布氏漏斗的瓶口斜面未朝向抽滤瓶的支管口;抽滤完毕或中途停止抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管,然后关闭抽气装置中的水龙头.
②该方案存在明显缺陷,因为得到的产物晶体中往往含有Cu(OH)2或Cu2(OH)2SO4杂质,产生该杂质的原因是加热蒸发过程中NH3挥发,使反应[Cu(NH3)4]2+?Cu2++4NH3平衡往右移动,且Cu2+发生水解.
(2)方案2的实验步骤为:
a.向溶液C加入适量乙醇b.抽滤(或吸滤、减压过滤)c.洗涤,d.干燥
①请在上述内填写合适的试剂或操作名称.
②下列选项中,最适合作为步骤c的洗涤液是C.
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
③步骤d不宜采用加热干燥的方法,可能的原因是加热易使[Cu(NH3)4]SO4•H2O分解(失去水或失去氨气).
分析 CuO加入硫酸生成硫酸铜,加入氨水,先生成氢氧化铜,氨水过量,则生成[Cu(NH3)4]2+,方案1用蒸发结晶的方法,得到的晶体中可能混有氢氧化铜等;方案2加入乙醇,可析出晶体Cu(NH3)4]SO4•H2O,
(1)①根据布氏漏斗的瓶口斜面放置位置分析;根据抽滤操作注意事项分析;
②氨气具有挥发性,物质的电离是吸热过程,加热促进使反应[Cu(NH3)4]2+?Cu2++4NH3平衡往右移动,且铜离子是弱碱离子易水解,所以导致产生杂质;
(2)①根据图象分析,[Cu(NH3)4]SO4•H2O在乙醇•水混合溶剂中的溶解度随乙醇体积分数的增大而减小,为了减少[Cu(NH3)4]SO4•H2O的损失,应加入乙醇,降低其溶解度,然后抽滤的晶体;
②根据图象[Cu(NH3)4]SO4•H2O在乙醇•水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图及实验目的分析;
③含结晶水的晶体加热易失水,不宜采用加热干燥的方法.
解答 解:(1)①方案1,为了加快过滤速度得到较干燥的沉淀,可进行减压过滤(也称抽滤或吸滤)题目图3所示装置为抽滤装置,装置中存在的错误是:布氏漏斗的颈口斜面未朝向抽滤瓶的支管口,这样不利于吸滤.抽滤完毕或中途停止抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管,然后关闭抽气装置中的水龙头.
故答案为:布氏漏斗的瓶口斜面未朝向抽滤瓶的支管口;断开连接安全瓶与抽气装置间的橡皮管;关闭抽气装置中的水龙头;
②该方案存在明显缺陷,因为得到的产物晶体中往往含有Cu(OH)2或Cu2(OH)2SO4杂质,产生该杂质的原因是加热蒸发过程中NH3挥发,使反应[Cu(NH3)4]2+?Cu2++4NH3平衡向右移动,且Cu2+发生水解.
故答案为:Cu(OH)2或Cu2(OH)2SO4;加热蒸发过程中NH3挥发,使反应[Cu(NH3)4]2+?Cu2++4NH3平衡往右移动,且Cu2+发生水解;
(2)①根据Cu(NH3)4]SO4•H2O在乙醇•水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图知,随着乙醇体积分数的增大,Cu(NH3)4]SO4•H2O的溶解度降低,为了得到Cu(NH3)4]SO4•H2O,应向溶液C中加入适量乙醇,然后进行抽滤;
故答案为:乙醇;抽滤(或吸滤、减压过滤);
②根据Cu(NH3)4]SO4•H2O在乙醇•水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图知,随着乙醇体积分数的增大,Cu(NH3)4]SO4•H2O的溶解度降低,为了减少Cu(NH3)4]SO4•H2O的损失,应降低Cu(NH3)4]SO4•H2O的溶解度,所以应选用乙醇和水的混合液;
故答案为:C;
③[Cu(NH3)4]SO4•H2O在加热条件下能分解生成水和氨气,从而得不到纯净的[Cu(NH3)4]SO4 •H2O,所以不宜采用加热干燥的方法.
故答案为:加热易使[Cu(NH3)4]SO4•H2O 分解(失去水或失去氨气).
点评 本题考查物质的制备,为高考常见题型,侧重于学生的分析能力、实验能力的考查,题目涉及化学平衡移动、结晶方式的分析等,弄清实验原理、目的、要求、步骤和注意事项是解题的关键,中等难度.

 名校课堂系列答案
名校课堂系列答案| A. | Na0H固体在空气中变质 | B. | 钢铁生锈 | ||
| C. | 物质的燃烧 | D. | 植物的光合作用 |


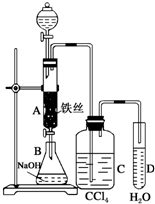 某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中. .
.

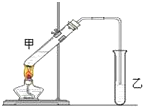 俗话说:“陈酒老醋特别香”,其原因是酒在存储过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示装置来模拟该过程,请回答下列问题:
俗话说:“陈酒老醋特别香”,其原因是酒在存储过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示装置来模拟该过程,请回答下列问题: