题目内容
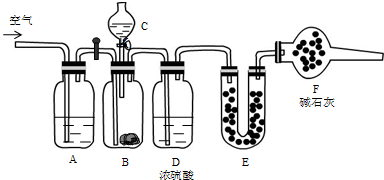
 用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去).称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解.实验前量气管起始读数为amL,实验后量气管的最终读数为bmL.
用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去).称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解.实验前量气管起始读数为amL,实验后量气管的最终读数为bmL.请回答下列问题:
(1)按上图完成装置连接,开始实验前必须进行的操作是
(2)写出锥形瓶中发生化合反应的离子方程式:
(3)实验结束后,锥形瓶内溶液中存在的金属离子有哪些可能?请根据选项进行填空(表格不一定填完):
A.盐酸 B.KSCN溶液 C.酸性KMnO4溶液 D.H2O2溶液
| 序号 | 溶液中可能存在 的金属离子 | 选择最少种数的试剂,验证该 假设(填字母) |
| ① | ||
| ② | ||
| ③ |
(5)若样品与足量稀硫酸反应后滴入KSCN溶液不显红色且量气管读数b>a(该实验条件下的气体摩尔体积为Vm).下列有关单质铁质量分数的计算过程是否正确?

考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)完成装置连接,开始实验前必须进行的操作是检查装置的气密性;
(2)锥形瓶中发生的反应有:Fe2O3+6H+=2Fe 3++3H2O、2Fe3++Fe=3Fe2+和Fe+2H+=Fe 2++H2↑,其中化合反应为2Fe3++Fe=3Fe2+;
(3)根据题意可知,锥形瓶内溶液中存在的金属离子只有以下两种情况:一是只含Fe2+,检验溶液中只含Fe2+时,选用KSCN溶液,其现象是溶液不变红色.二是既含Fe2+又含Fe3+,检验时取两份少量的该溶液,向一份溶液中滴加KSCN溶液,溶液变红,说明含Fe3+;向另一份溶液中滴加酸性KMnO4溶液,紫色褪去,说明含Fe2+;
(4)测定气体体积时要注意压强对气体体积的影响,若液面左高右低,会造成右管内气体压强偏大,气体体积偏小,上下调节右管,使右管液面高度与测量气管中液面高度平齐;
(5)混合物中Fe2O3与硫酸反应后生成的Fe3+可进一步消耗铁单质;
(2)锥形瓶中发生的反应有:Fe2O3+6H+=2Fe 3++3H2O、2Fe3++Fe=3Fe2+和Fe+2H+=Fe 2++H2↑,其中化合反应为2Fe3++Fe=3Fe2+;
(3)根据题意可知,锥形瓶内溶液中存在的金属离子只有以下两种情况:一是只含Fe2+,检验溶液中只含Fe2+时,选用KSCN溶液,其现象是溶液不变红色.二是既含Fe2+又含Fe3+,检验时取两份少量的该溶液,向一份溶液中滴加KSCN溶液,溶液变红,说明含Fe3+;向另一份溶液中滴加酸性KMnO4溶液,紫色褪去,说明含Fe2+;
(4)测定气体体积时要注意压强对气体体积的影响,若液面左高右低,会造成右管内气体压强偏大,气体体积偏小,上下调节右管,使右管液面高度与测量气管中液面高度平齐;
(5)混合物中Fe2O3与硫酸反应后生成的Fe3+可进一步消耗铁单质;
解答:
解:(1)完成装置连接,开始实验前必须进行的操作是检查装置的气密性;
故答案为:检查装置的气密性;
(2)锥形瓶中发生的反应有:Fe2O3+6H+=2Fe 3++3H2O、2Fe3++Fe=3Fe2+和Fe+2H+=Fe 2++H2↑,其中2Fe3++Fe=3Fe2+属于化合反应;
故答案为:2Fe3++Fe=3Fe2+;
(3)根据题意可知,锥形瓶内溶液中存在的金属离子只有以下两种情况:一是只含Fe2+,检验溶液中只含Fe2+时,选用KSCN溶液,其现象是溶液不变红色.二是既含Fe2+又含Fe3+,检验时取两份少量的该溶液,向一份溶液中滴加KSCN溶液,溶液变红,说明含Fe3+;向另一份溶液中滴加酸性KMnO4溶液,紫色褪去,说明含Fe2+,故答案为:
(4)读数时应注意:
①将实验装置恢复到室温;②上下调节右管,使右管液面高度与测量气管中液面高度平齐;③视线与凹液面最低处相平;
若读取量气管中气体的体积时,液面左高右低,会造成右管内气体压强偏大,气体体积偏小;
故答案为:上下调节右管,使右管液面高度与测量气管中液面高度平齐;偏小;
(5)该计算过程不正确,忽视了锥形瓶中的反应2Fe3++Fe=3Fe2+,混合物中Fe2O3与硫酸反应后生成的Fe3+可进一步消耗铁单质;
故答案为:否;混合物中Fe2O3与硫酸反应后生成的Fe3+可进一步消耗铁单质;
故答案为:检查装置的气密性;
(2)锥形瓶中发生的反应有:Fe2O3+6H+=2Fe 3++3H2O、2Fe3++Fe=3Fe2+和Fe+2H+=Fe 2++H2↑,其中2Fe3++Fe=3Fe2+属于化合反应;
故答案为:2Fe3++Fe=3Fe2+;
(3)根据题意可知,锥形瓶内溶液中存在的金属离子只有以下两种情况:一是只含Fe2+,检验溶液中只含Fe2+时,选用KSCN溶液,其现象是溶液不变红色.二是既含Fe2+又含Fe3+,检验时取两份少量的该溶液,向一份溶液中滴加KSCN溶液,溶液变红,说明含Fe3+;向另一份溶液中滴加酸性KMnO4溶液,紫色褪去,说明含Fe2+,故答案为:
| 序号 | 溶液中可能存在 的金属离子 | 选择最少种数的试剂,验证该 假设(填字母) |
| ① | 只有Fe 2+ | B |
| ② | 既有Fe 3+又有Fe 2+; | BC |
| ③ |
①将实验装置恢复到室温;②上下调节右管,使右管液面高度与测量气管中液面高度平齐;③视线与凹液面最低处相平;
若读取量气管中气体的体积时,液面左高右低,会造成右管内气体压强偏大,气体体积偏小;
故答案为:上下调节右管,使右管液面高度与测量气管中液面高度平齐;偏小;
(5)该计算过程不正确,忽视了锥形瓶中的反应2Fe3++Fe=3Fe2+,混合物中Fe2O3与硫酸反应后生成的Fe3+可进一步消耗铁单质;
故答案为:否;混合物中Fe2O3与硫酸反应后生成的Fe3+可进一步消耗铁单质;
点评:本题考查了物质组成的分析判断,实验过程分析,气体体积的量取方法和正确读数的步骤分析,掌握基础是关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
不能鉴别乙酸溶液、乙醇溶液的试剂是( )
| A、氢氧化钠溶液 |
| B、氢氧化铜悬浊液 |
| C、石蕊试液 |
| D、碳酸钠溶液 |
 化工试剂草酸钠常用于制革、烟火、整理织物等.纯Na2C2O4为白色晶体,溶于水,不溶于乙醇,有还原性.实验室可用标准KMnO4溶液测定市售草酸钠中Na2C2O4的质量分数(假设杂质不与KMnO4反应).
化工试剂草酸钠常用于制革、烟火、整理织物等.纯Na2C2O4为白色晶体,溶于水,不溶于乙醇,有还原性.实验室可用标准KMnO4溶液测定市售草酸钠中Na2C2O4的质量分数(假设杂质不与KMnO4反应).
 为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案.请回答每个方案中提出的问题.
为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案.请回答每个方案中提出的问题.
 .
.