题目内容
下列说法中正确的是( )
| A、H与O可形成既含极性共价键又含非极性共价键的化合物 |
| B、非金属元素组成的化合物中只含共价键 |
| C、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D、Na2O与Na2O2中阴阳离子个数比不相等 |
考点:共价键的形成及共价键的主要类型,离子化合物的结构特征与性质
专题:化学键与晶体结构
分析:A.同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,H与O可形成既含极性共价键又含非极性共价键的化合物;
B.非金属元素组成的化合物中可能含有离子键;
C.HCl是共价化合物;
D.Na2O与Na2O2中阴阳离子个数比都是1:2.
B.非金属元素组成的化合物中可能含有离子键;
C.HCl是共价化合物;
D.Na2O与Na2O2中阴阳离子个数比都是1:2.
解答:
解:A.H与O可形成既含极性共价键又含非极性共价键的化合物,如H-O-O-H,故A正确;
B.非金属元素组成的化合物中可能含有离子键,如铵盐,故B错误;
C.HCl分子是由H原子和Cl原子构成的,H原子和Cl原子之间只存在共价键,所以HCl为共价化合物,故C错误;
D.Na2O与Na2O2中阴阳离子个数比都是1:2,所以其阴阳离子个数之比相等,故D错误;
故选A.
B.非金属元素组成的化合物中可能含有离子键,如铵盐,故B错误;
C.HCl分子是由H原子和Cl原子构成的,H原子和Cl原子之间只存在共价键,所以HCl为共价化合物,故C错误;
D.Na2O与Na2O2中阴阳离子个数比都是1:2,所以其阴阳离子个数之比相等,故D错误;
故选A.
点评:本题考查了化学键的判断,明确物质的构成微粒及微粒间的作用力即可解答,注意D中过氧化钠中阴离子是过氧根离子而不是氧离子,易错选项是BD,会利用反例法分析解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
配置0.5mol/L的碳酸钠溶液250mL时,下列仪器不需要的是( )
A、 |
B、 |
C、 |
D、 |
铜~锌原电池,电解质溶液为稀硫酸,当该原电池工作时( )
| A、铜电极上发生氧化反应 |
| B、铜电极上发生还原反应 |
| C、电子从铜极经过外电路流向锌极 |
| D、电解质溶液中H+浓度不变 |
磷-32在小儿皮肤血管瘤方面有着很好的疗效,下面关于31P和32P的说法中正确的是( )
| A、31P和32P具有相同的中子数 |
| B、31P和32P互为同位素 |
| C、31P和32P的核外电子数不同 |
| D、31P和32P的中子数分别为31和32 |
在伪劣美白化妆品中常添加双氧水起到快速美白的效果,使用时间长了会对皮肤造成强烈刺激,严重的可能烧坏表皮层,让皮肤变粗糙、长疱.可采用高锰酸钾溶液检验化妆品中是否含有双氧水,该反应的方程式为:2KMnO4+3H2O2→2MnO2+2KOH+3O2↑+2H2O,下列有关说法正确的是( )
| A、1mol的高锰酸钾参与反应有6mol电子发生转移 |
| B、高锰酸钾与双氧水都是常见氧化剂,高锰酸钾的氧化性比双氧水弱 |
| C、上反应中双氧水做还原剂 |
| D、在高锰酸钾溶液中加入足量含有双氧水的化妆品样品,溶液也不会褪色 |
不能通过两种单质间化合直接得到的是( )
| A、FeS |
| B、CuCl2 |
| C、HCl |
| D、FeCl2 |
第三周期主族元素中,原子半径最大的是( )
| A、Na | B、Si | C、S | D、Cl |
关于晶体与化学键关系的下列说法中,正确的是( )
| A、离子晶体中一定存在共价键 |
| B、原子晶体中可能存在离子键 |
| C、金属晶体中存在离子,但却不存在离子键 |
| D、分子晶体中一定存在共价键 |
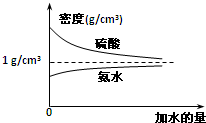 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题: