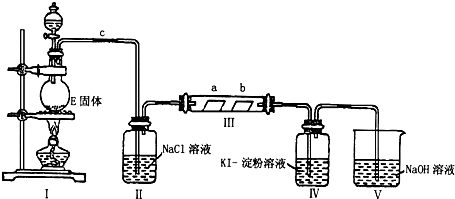
题目内容
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大.A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M.1molM中含有42mol电子.回答下列问题:
(1)E元素在周期表中的位置 ;化合物M中含有的化学键类型有 .
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是 (用化学式表示);写出C与A形成的18e-化合物的电子式 ,该化合物类型为 (填“共价化合物”或“离子化合物”).
(3)写出C与E两元素形成的化合物与Y溶液反应的离子方程式 ;写出题中生成M的化学方程式 .
(1)E元素在周期表中的位置
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是
(3)写出C与E两元素形成的化合物与Y溶液反应的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:E的单质可做半导体材料,应为Si元素,B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M,则B应为非金属元素,只有N元素符合,形成的化合物为NH4NO3,1mol中含有42mol电子,B、D、E三种元素原子的最外层电子数之和为10,则D的最外层电子数为10-4-5=1,又D的原子序数大于B小于E,应为Na元素,A、D同主族,且A的原子序数小于B,应为H元素,根据C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应,应是SiO2和NaOH的反应,则C为O元素,根据原子的结构、元素对应单质、化合物的性质结合元素周期律可解答该题.
解答:
解:E的单质可做半导体材料,应为Si元素,B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M,则B应为非金属元素,只有N元素符合,形成的化合物为NH4NO3,1mol中含有42mol电子,B、D、E三种元素原子的最外层电子数之和为10,则D的最外层电子数为10-4-5=1,又D的原子序数大于B小于E,应为Na元素,A、D同主族,且A的原子序数小于B,应为H元素,根据C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应,应是SiO2和NaOH的反应,则C为O元素,
(1)由以上分析可知E为Si元素,原子序数为14,原子核外有3个电子层,最外层电子数为4,则应位于周期表第三周期、第ⅣA族,M为NH4NO3,为离子化合物,含有离子键和极性共价键,故答案为:第三周期第ⅣA族;离子键和极性共价键;
(2)B、C、E形成的气态氢化物分别为NH3、H2O、SiH4,由于非金属性O>N>Si,则氢化物稳定性为H2O>NH3>SiH4,C与A形成的化合物中,H2O2含有18个e-,其电子式为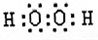 ,该物质为共价化合物,故答案为:H2O>NH3>SiH4;
,该物质为共价化合物,故答案为:H2O>NH3>SiH4;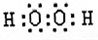 ;共价化合物;
;共价化合物;
(3)SiO2为酸性氧化物,与NaOH反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O,题中生成M的化学方程式为NH3+HNO3=NH4NO3,
故答案为:SiO2+2OH-=SiO32-+H2O;NH3+HNO3=NH4NO3.
(1)由以上分析可知E为Si元素,原子序数为14,原子核外有3个电子层,最外层电子数为4,则应位于周期表第三周期、第ⅣA族,M为NH4NO3,为离子化合物,含有离子键和极性共价键,故答案为:第三周期第ⅣA族;离子键和极性共价键;
(2)B、C、E形成的气态氢化物分别为NH3、H2O、SiH4,由于非金属性O>N>Si,则氢化物稳定性为H2O>NH3>SiH4,C与A形成的化合物中,H2O2含有18个e-,其电子式为
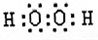 ,该物质为共价化合物,故答案为:H2O>NH3>SiH4;
,该物质为共价化合物,故答案为:H2O>NH3>SiH4;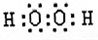 ;共价化合物;
;共价化合物;(3)SiO2为酸性氧化物,与NaOH反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O,题中生成M的化学方程式为NH3+HNO3=NH4NO3,
故答案为:SiO2+2OH-=SiO32-+H2O;NH3+HNO3=NH4NO3.
点评:本题考查较为综合,在元素推断的基础上考查电子式、物质的组成和性质以及原电池知识,本题中注意从物质的用途、结构和性质等角度推断,学习中注重相关基础的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,11.2L氯仿中含有的C-Cl键的数目为1.5NA |
| B、标准状况下,30g NO和16g O2混合所生成的气体分子数为NA |
| C、某温度时,1L pH=6的纯水中含有1.0×10-6NA个H+ |
| D、28g铁粉与足量Cl2反应时转移的电子数为NA |
 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2N(g)+W(g),△H>0达到平衡时,v(A)=1.2aL,则下列说法错误的是( )
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2N(g)+W(g),△H>0达到平衡时,v(A)=1.2aL,则下列说法错误的是( )| A、反应开始时,B容器中化学反应速率快 |
| B、A容器中X的转化率为40%,且比B中X的转化率小 |
| C、打开K一段时间,达到新平衡时,A的体积为2.6aL(两边通管中气体体积不计) |
| D、打开K达新平衡后,升高B容器温度,A容器体积会增大 |
实验室要用98%(密度为1.84g?cm-3)的硫酸配制3.68mol/L的硫酸500mL.若配制3.68mol/L的硫酸,其他操作均正确,下列操作会使所配硫酸溶液浓度偏低的是( )
| A、将稀释的硫酸转移至容量瓶后,未洗涤烧杯和玻璃棒 |
| B、将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外 |
| C、用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度线,此时立即用胶头滴管将瓶内多余液体吸出,使溶液凹液面与刻度线相切 |
| D、用胶头滴管向容量瓶中加入水时,仰视观察溶液凹液面与容量瓶刻度线相切 |