题目内容
关于下列化学物质的说法,正确的是( )
| A、MgO和Al2O3在工业上均可用于制耐高温材料,也常用于电解法冶炼镁、铝两种金属 |
| B、因为沸点Na>K,所以反应Na+KCl=K+NaCl能进行,可以用Na制得K |
| C、化学性质很不活泼的元素,在自然界中可能存在游离态单质,如:Pt、Si等元素 |
| D、Fe是黑色金属,但纯铁是银白色的,而且纯铁比生铁更容易被腐蚀 |
考点:镁、铝的重要化合物,碱金属的性质,铁的化学性质
专题:元素及其化合物
分析:A.氧化镁熔点高,耗能大;
B.利用高沸点制取低沸点;
C.硅为亲氧元素,易被氧化,所以在自然界中多数以化合态存在;
D.依据生铁含有杂质碳,铁和碳在表面电解质溶液中形成原电池反应,铁做负极被腐蚀分析判断;
B.利用高沸点制取低沸点;
C.硅为亲氧元素,易被氧化,所以在自然界中多数以化合态存在;
D.依据生铁含有杂质碳,铁和碳在表面电解质溶液中形成原电池反应,铁做负极被腐蚀分析判断;
解答:
解:A.MgO熔点高,电解前需要将其熔化,耗能大,制备Mg,电解熔融MgCl2而不是氧化镁,故A错误;
B.利用高沸点制取低沸点,因为沸点Na>K,所以反应Na+KCl=K+NaCl能进行,可以用Na制得K,故B正确;
C.硅为亲氧元素,易被氧化,所以在自然界中多数以化合态存在,故C错误;
D.在潮湿空气中生铁中含有杂质和铁与表面的电解质溶液形成原电池反应,铁做负极,生铁比纯铁容易被腐蚀,故D错误;
故选B.
B.利用高沸点制取低沸点,因为沸点Na>K,所以反应Na+KCl=K+NaCl能进行,可以用Na制得K,故B正确;
C.硅为亲氧元素,易被氧化,所以在自然界中多数以化合态存在,故C错误;
D.在潮湿空气中生铁中含有杂质和铁与表面的电解质溶液形成原电池反应,铁做负极,生铁比纯铁容易被腐蚀,故D错误;
故选B.
点评:本题考查了金属的冶炼、铁的腐蚀、硅在自然界的存在方式等知识点,难度不大,易错选项是A,注意根据金属的活泼性确定金属的冶炼方法,还要结合实际情况进行分析.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
下列各组反应中最终肯定有白色沉淀的是( )
| A、向饱和碳酸钠溶液中通入过量CO2 |
| B、氯化亚铁溶液中加入少量过氧化钠 |
| C、AlCl3溶液中加入过量氢氧化钠溶液 |
| D、氯化钙溶液中通入过量CO2 |
有铝、铁组成的混合物,分为等质量的两份,分别投入到足量的稀盐酸和足量的稀氢氧化钠溶液中,放出氢气体积比为2:1(同温同压下).则该混合物铝和铁的关系正确的是( )
| A、物质的量之比为1:1 |
| B、物质的量之比为2:3 |
| C、质量之比为56:27 |
| D、条件不足无法计算 |
下列说法不正确的是( )
| A、二氧化硅是生产光纤制品的基本原料 |
| B、水玻璃可用于生产黏合剂和防火剂 |
| C、涂油层、通过电镀加上金属层、制成合金等都是保护金属的措施 |
| D、相同条件下,溶液中Cu2+、Zn2+、H+、Na+的氧化性依次减弱 |
分类法是化学研究的重要方法,对下列物质的分类,正确的是( )
A、同分异构体: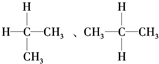 |
B、烷烃:CH4、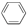 、CH2═CH2 、CH2═CH2 |
| C、糖类:葡萄糖、蔗糖、纤维素 |
| D、酸:乙酸、硫酸、油脂 |
下列说法中不正确的是( )
| A、人类历史上使用最早的合金是青铜 |
| B、合金的熔点比它的各成分金属的熔点都低 |
| C、合金中不一定含有金属 |
| D、目前世界上用途最广泛的合金是钢 |
下列离子方程式正确的是( )
| A、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B、向AlCl3溶液中加入NaAlO2:Al3++3AlO2-+6H2O=4Al (OH)3↓ |
| C、向AlCl3溶液中投入过量的Na:Na+Al3++2H2O=Na++AlO2-+2H2↑ |
| D、氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |