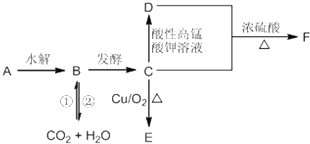
题目内容
Na2S2O3可用作照相的定影剂等.已知Na2S2O3的某些性质如下:
(1)S2O32-能被I2氧化为S4O62-; (2)酸性条件下S2O32-迅速分解为S和SO2
Ⅰ.市售Na2S2O3中常含有SO42-,请完成以下方案,检验其中含有的SO42-:
Ⅱ.利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度,步骤为:
①溶液配制:称取1.0g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL.
②滴定:取10.00mL0.01mol?L-1K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液.
③往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32-+I2═S4O62-+2I-),记录Na2S2O3溶液用量,平行滴定3次.
(1)步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、 和 .
(2)完成并配平步骤②中的离子反应:
Cr2O72-+ + I-═ I2+ Cr3++ H2O
(3)步骤③中,指示剂最好选用 ,该滴定应在接近中性的溶液中进行而不在强酸性溶液进行的原因是
(4)若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为 .
(Na2S2O3的摩尔质量为158g?mol-1).
(1)S2O32-能被I2氧化为S4O62-; (2)酸性条件下S2O32-迅速分解为S和SO2
Ⅰ.市售Na2S2O3中常含有SO42-,请完成以下方案,检验其中含有的SO42-:
| 实验步骤 | 预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
| 步骤2: | |
| 步骤3: |
①溶液配制:称取1.0g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL.
②滴定:取10.00mL0.01mol?L-1K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液.
③往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32-+I2═S4O62-+2I-),记录Na2S2O3溶液用量,平行滴定3次.
(1)步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、
(2)完成并配平步骤②中的离子反应:
(3)步骤③中,指示剂最好选用
(4)若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为
(Na2S2O3的摩尔质量为158g?mol-1).
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:Ⅰ.根据实验目的,酸性条件下S2O32-迅速分解为S和SO2设计检验含有S2O32-和加入BaCl2溶液检验SO42-;
Ⅱ.(1)步骤①是物质的量浓度的配制实验,使用的仪器有:烧杯、玻璃棒、100mL容量瓶、胶头滴管;
(2)根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等,表现为化合价升降的总数相等进行解答;
(3)步骤③中,根据反应有碘单质被还原,所以选用淀粉作指示剂;根据酸性条件下S2O32-迅速分解为S和SO2分析;
(4)根据方程式中 I2、S2O32-之间的关系式计算;
Ⅱ.(1)步骤①是物质的量浓度的配制实验,使用的仪器有:烧杯、玻璃棒、100mL容量瓶、胶头滴管;
(2)根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等,表现为化合价升降的总数相等进行解答;
(3)步骤③中,根据反应有碘单质被还原,所以选用淀粉作指示剂;根据酸性条件下S2O32-迅速分解为S和SO2分析;
(4)根据方程式中 I2、S2O32-之间的关系式计算;
解答:
解:Ⅰ.因为酸性条件下S2O32-迅速分解为S和SO2,所以可以加入盐酸,看是否有浅黄色浑浊出现和有刺激性气体产生;静置后取上层清液,加入BaCl2溶液,看有无白色沉淀产生,说明样品中含有SO42-,
故答案为:
Ⅱ.(1)步骤①是物质的量浓度的配制实验,使用的仪器有:烧杯、玻璃棒、100mL容量瓶、胶头滴管;故答案为:100mL容量瓶;胶头滴管;
(2)反应中Cr元素化合价由+6价降低到+3价,I元素化合价由-1价升高到0价,则根据化合价升降总数相等结合质量守恒可知配平后的方程式应为Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,故答案为:1;14H+; 6;3;2;7;
(3)步骤③中,根据反应有碘单质被还原,所以选用淀粉作指示剂;因为酸性条件下S2O32-迅速分解为S和SO2,影响样品纯度的测定,所以滴定应在接近中性的溶液中进行,故答案为:淀粉;酸性时S2O32-迅速分解为S和SO2,影响样品纯度的测定;
(4)根据方程式,Cr2O72-~3I2~6S2O32-得C(S2O32-)=
=0.05mol/L,m(Na2S2O3)=158g/mol×0.05mol/L×0.1L=0.79g,质量分数=
×100%=79%,
故答案为:79%.
故答案为:
| 实验步骤 | 预期现象或结论 |
| 加入过量盐酸 | 有浅黄色浑浊出现、有刺激性气体产生 |
| 静置后取上层清液,加入BaCl2溶液 | 有白色沉淀产生,说明样品中含有SO42- |
(2)反应中Cr元素化合价由+6价降低到+3价,I元素化合价由-1价升高到0价,则根据化合价升降总数相等结合质量守恒可知配平后的方程式应为Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,故答案为:1;14H+; 6;3;2;7;
(3)步骤③中,根据反应有碘单质被还原,所以选用淀粉作指示剂;因为酸性条件下S2O32-迅速分解为S和SO2,影响样品纯度的测定,所以滴定应在接近中性的溶液中进行,故答案为:淀粉;酸性时S2O32-迅速分解为S和SO2,影响样品纯度的测定;
(4)根据方程式,Cr2O72-~3I2~6S2O32-得C(S2O32-)=
| 10×0.01×6 |
| 12 |
| 0.79 |
| 1.0 |
故答案为:79%.
点评:本题主要考查了杂质离子的检测实验设计及其滴定法测定含量的过程,有关信息应用和化学方程式的计算,实验步骤判断是解题关键,题目难度中等.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
下列情况对中和滴定结果无影响的是( )
| A、盛待测液的锥形瓶滴定前用待测液润洗 |
| B、滴定管尖嘴部分在滴定前有气泡,滴定后气泡消失 |
| C、滴定到达终点时,视线高于滴定管内凹液面的最低点读数 |
| D、滴定管在滴定前未将液面调至“0”刻度除,而是在“2.40”刻度处 |
一定温度下,用水稀释0.1mol?L-1的一元弱酸HA,随着水量的增加,下列数值一定增大的是( )
| A、Kw |
| B、c(H+)/Ka |
| C、c(HA)/c(A-) |
| D、c(OH-) |