题目内容
6.分析表中各项的排布规律,按此规律排布第23项应为( )| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C2H6 | C2H4 | C2H4O2 | C3H8 | C3H6 | C3H6O2 | C4H10 | C4H8 | C4H8O2 | C5H12 |
| A. | C9H18 | B. | C9H118O2 | C. | C8H18 | D. | C8H16O2 |
分析 根据表中排布可知,每3个为一组,第一组碳原子为数为2,分别符合通式CnH2n+2、CnH2n、CnH2nO2,第二组碳原子为数为3,分别符合通式CnH2n+2、CnH2n、CnH2nO2,所以按此规律排布的第23项是第8组中的第二个,应为烯烃,以此解答该题.
解答 解:根据表中排布可知,每3个为一组,第一组碳原子为数为2,分别符合通式CnH2n+2、CnH2n、CnH2nO2,第二组碳原子为数为3,分别符合通式CnH2n+2、CnH2n、CnH2nO2,所以按此规律排布的第23项是第8组中的第二个,含有9个C原子,应为烯烃,分子式为C9H18,
故选A.
点评 本题主要考查有机物分子式的确定,侧重于学生的分析能力的考查,题目难度中等,注意掌握常见有机物结构与性质,根据排布规律推导出有机物的分子式是解题的关键.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
16.向下列物质的溶液中通入CO2,不发生反应的是( )
| A. | Na2CO3 | B. | NaOH | C. | Na2SiO3 | D. | CaCl2 |
17.X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如表:
(1)W的原子结构示意图为 ; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).
; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).
(2)X与氢两元素按原子数目比1:3构成分子A,A的电子式为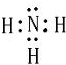 ;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).
;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的气态氢化物的稳定性比X的气态氢化物的稳定性若(填“强”或“弱”).
(4)检验溶液中R3+常用的试剂是KSCN溶液,可以观察到的现象是溶液呈红色.
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 ; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).
; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).(2)X与氢两元素按原子数目比1:3构成分子A,A的电子式为
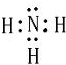 ;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).
;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的气态氢化物的稳定性比X的气态氢化物的稳定性若(填“强”或“弱”).
(4)检验溶液中R3+常用的试剂是KSCN溶液,可以观察到的现象是溶液呈红色.
11.一定量的铁粉和过量的3mol•L-1硫酸反应,当向其中加入少量的下物质:①铁片 ②铜粉 ③浓硫酸 ④石墨 ⑤二氧化锰 ⑥饱和食盐水 ⑦CuSO4 ⑧NaNO3晶体时,能够加快反应速率,又不影响产生H2总量的是( )
| A. | ①③⑧ | B. | ②③④ | C. | ①④⑥ | D. | ④⑤⑦ |
15.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 碱金属单质都能在氧气中燃烧生成过氧化物 | |
| B. | N、O、F氢化物的稳定性依次减弱 | |
| C. | P、S、Cl最高正价依次升高 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |


