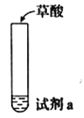
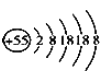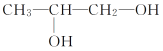题目内容
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:H2C2O4是弱电解质)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是( )
A.H2C2O4有酸性:Ca(OH)2+ H2C2O4=CaC2O4↓+2H2O
B.酸性H2C2O4> H2CO3:NaHCO3+ H2C2O4=NaHC2O4+CO2↑+H2O
C.H2C2O4具有还原性:2![]() +5
+5![]() +16H+=2Mn2++10CO2↑+ 8H2O
+16H+=2Mn2++10CO2↑+ 8H2O
D.H2C2O4可发生酯化反应:HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
【答案】C
【解析】
草酸(又称乙二酸)为一种二元弱酸,具有酸的通性,因此能发生中和反应;具有还原性;因为乙二酸中含有羧基因此能发生酯化反应,据此解题。
A.H2C2O4为二元弱酸,能与氢氧化钙溶液发生中和反应,生成白色沉淀草酸钙和水,因此氢氧化钙溶液碱性逐渐减弱,溶液红色褪去,A正确;
B.产生气泡证明有CO2 产生,因此可证明酸性H2C2O4>H2CO3,反应方程式为:H2C2O4+2NaHCO3=Na2C2O4+2CO2↑+2H2O,B正确;
C.草酸为弱电解质,故在其参与的离子方程式中要写其化学式,不能用草酸根表示,正确的离子方程式为2![]() +5H2C2O4+6H+=2Mn2++10CO2↑+ 8H2O,C错误;
+5H2C2O4+6H+=2Mn2++10CO2↑+ 8H2O,C错误;
D.草酸(又称乙二酸),结构中含有两个羧基,因此其能发生酯化反应,生成乙二酸二乙醇酯,反应方程式正确,D正确;
故选C。

【题目】现有 8 种元素的性质、数据如下表所列,它们属于第二或第三周期。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
回答下列问题:
(1)④的元素名称是_____,⑧的元素符号是_____。②在元素周期表中的位置是(周期、族)_____ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____;名称是________; 碱性最强的化合物的电子式是:_________; 属_____化合物(填“离子”或“共价”)。
(3)①的最简单氢化物的电子式为_____, ⑦的最简单氢化物的电子式为_____,结构式为_____。
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:_________________ 。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:____________。
【题目】对于反应:![]() ,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。
,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3的速率 |
① | 升高温度 | _______ |
② | 降低温度 | _______ |
③ | 增大O2的浓度 | _______ |
④ | 使用V2O5作催化剂 | _______ |