题目内容
【题目】Na2S粗品含有杂质,其纯化、含量测定方法如下。回答下列问题:
(1)粗品经水浸、过滤、__________________、洗涤、干燥等操作可以除去不溶性杂质,得到较纯的Na2S固体。
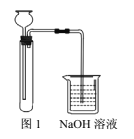
(2)国标中采用如图所示装置测定Na2S样品溶液中Na2CO3的百分含量(实验前,吸收管1、吸收管2、参比管中均装入组成相同的乙醇、丙酮混合溶液,该溶液吸收CO2后,颜色发生改变) 。

(步骤一)标定KOH标准溶液
准确称取w g邻苯二甲酸氢钾(KC8H5O4,摩尔质量为M g/mol)置于锥形瓶中,加入适量蒸馏水、2滴指示剂,用待标定的KOH溶液滴定至终点,消耗v mL KOH溶液。
①标定过程中应该选用的指示剂名称是______,理由是__________;
(已知邻苯二甲酸的电离平衡常数为Ka1=1.1×10-3,Ka2=4.0×10-6)
②KOH溶液的准确浓度为_____mol/L(用含M、v、w的代数式表示)
(步骤二)往三颈烧瓶中先后加入100mL 样品溶液、15 ml过氧化氢溶液(足量),连接好装置,加热并打开抽气装置;
(步骤三)上述反应完成后,从滴液漏斗中慢慢加入足量稀硫酸溶液,充分反应;
(步骤四)用装置6中的KOH标准溶液滴定吸收管1中的溶液至与参比管中溶液相同的颜色,3 min内不变色为终点。
③过氧化氢的作用是______;碱石棉的作用是__________;
④如果抽气速度过快,可能导致测定结果_________(填“偏高”、“偏低”或“无影响”);
⑤若步骤三中出现_______________________(填现象),说明实验失败,必须重新测定。
【答案】蒸发浓缩、冷却结晶、过滤 酚酞 滴定终点为邻苯二甲酸钾的水溶液,呈碱性 ![]() 氧化除去S2- 除去空气中的CO2 偏低 吸收管2中的溶液颜色发生明显变化
氧化除去S2- 除去空气中的CO2 偏低 吸收管2中的溶液颜色发生明显变化
【解析】
(1)粗品经水浸、过滤、蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作可以除去不溶性杂质,得到较纯的Na2S固体。
(2)①根据滴定终点溶液的性质选择指示剂;
②根据KC8H5O4+KOH= K2C8H4O4+H2O找到数量关系,进行计算;
③过氧化氢具有氧化性,为了实验结果准确要防止空气中的二氧化碳被吸收;
④抽气过快反应不能完全进行;
⑤步骤四中只滴定吸收管1中的溶液,则要保证吸收管1可以吸收全部二氧化碳。
(1)粗品经水浸、过滤、蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作可以除去不溶性杂质,得到较纯的Na2S固体。故答案为:蒸发浓缩、冷却结晶、过滤;
(2)①滴定终点为邻苯二甲酸钾的水溶液,存在邻苯二甲酸根的水解,导致溶液呈碱性,所以选用酚酞做指示剂,故答案为:酚酞;滴定终点为邻苯二甲酸钾的水溶液,呈碱性;
②滴定过程发生反应KC8H5O4+KOH= K2C8H4O4+H2O,则反应中邻苯二甲酸氢钾的物质的量与氢氧化钾物质的量相同,n(KC8H5O4)=![]() mol,则n(KOH)=
mol,则n(KOH)=![]() mol,浓度c=
mol,浓度c=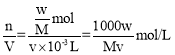 ,故答案为
,故答案为![]() ;
;
③过氧化氢具有氧化性,可以将硫离子氧化,以免生成硫化氢影响实验结果;为了实验结果准确要防止空气中的二氧化碳被吸收,故答案为:氧化除去S2-;除去空气中的CO2;
④抽气过快二氧化碳不能完全被吸收,继而使测量结果偏小,故答案为:偏小;
⑤步骤四中只滴定吸收管1中的溶液,则要保证吸收管1可以吸收全部二氧化碳,当吸收管2中颜色发生变化时,说明有二氧化碳在吸收管1中没有完全被吸收,实验失败,故答案为:吸收管2中的溶液颜色发生明显变化。

 全优点练单元计划系列答案
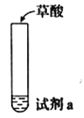
全优点练单元计划系列答案【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:H2C2O4是弱电解质)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是( )
A.H2C2O4有酸性:Ca(OH)2+ H2C2O4=CaC2O4↓+2H2O
B.酸性H2C2O4> H2CO3:NaHCO3+ H2C2O4=NaHC2O4+CO2↑+H2O
C.H2C2O4具有还原性:2![]() +5
+5![]() +16H+=2Mn2++10CO2↑+ 8H2O
+16H+=2Mn2++10CO2↑+ 8H2O
D.H2C2O4可发生酯化反应:HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O