题目内容
【题目】现有四种有机化合物:
甲:![]() 乙:
乙:![]() 丙:
丙:![]() 丁:
丁:
试回答:
(1)甲、乙、丁都含有的官能团的名称是________,四种物质中互为同分异构体的是________(填编号,下同)。
(2)1 mol甲、乙、丁分别与足量Na反应,生成H2最多的是_______________。
(3)丁与醋酸在催化剂作用下发生取代反应生成的酯有__________种。
(4)①写出甲与乙醇发生酯化反应的化学方程式:_____________________。
②写出乙与新制氢氧化铜悬浊液反应的化学方程式:_______________。
【答案】羟基 乙和丙 甲 3 ![]() +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O
+H2O ![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O
+Cu2O↓+3H2O
【解析】
(1)甲、乙、丁都含有的官能团为羟基;乙和丙的分子式都为C3H6O2,但结构不同;
(2)1mol甲与足量Na反应生成![]() molH2,1mol乙与足量Na反应生成
molH2,1mol乙与足量Na反应生成![]() molH2, 1mol丁与足量Na反应生成1molH2;
molH2, 1mol丁与足量Na反应生成1molH2;
(3)丁分子中含有2个羟基,若1mol丁与等物质的量的乙酸反应可以生成2种乙酸酯,若1mol丁与2mol乙酸反应可以生成1种乙酸酯;
(4)①在浓硫酸作用下,甲与乙醇共热发生酯化反应生成![]() 和水;
和水;
②乙含有醛基,碱性条件下,乙与新制氢氧化铜悬浊液共热反应生成![]() 、Cu2O砖红色沉淀和H2O。
、Cu2O砖红色沉淀和H2O。
(1)甲的结构简式为![]() ,官能团为羟基和羧基,乙的结构简式为
,官能团为羟基和羧基,乙的结构简式为![]() ,官能团为羟基和醛基,丁的结构简式为
,官能团为羟基和醛基,丁的结构简式为 ,官能团为羟基,则甲、乙、丁都含有的官能团为羟基;乙和丙的分子式都为C3H6O2,但结构不同,互为同分异构体,故答案为:羟基;乙和丙;
,官能团为羟基,则甲、乙、丁都含有的官能团为羟基;乙和丙的分子式都为C3H6O2,但结构不同,互为同分异构体,故答案为:羟基;乙和丙;
(2)甲分子中羟基和羧基都能与金属钠反应,1mol甲与足量Na反应生成![]() molH2,乙分子中羟基能与金属钠反应,1mol乙与足量Na反应生成
molH2,乙分子中羟基能与金属钠反应,1mol乙与足量Na反应生成![]() molH2,丁分子中羟基能与金属钠反应,1mol丁与足量Na反应生成1molH2,则生成H2最多的是甲,故答案为:甲;
molH2,丁分子中羟基能与金属钠反应,1mol丁与足量Na反应生成1molH2,则生成H2最多的是甲,故答案为:甲;
(3)丁分子中含有2个羟基,若1mol丁与等物质的量的乙酸反应可以生成 和
和 2种酯,若1mol丁与2mol乙酸反应可以生成
2种酯,若1mol丁与2mol乙酸反应可以生成 1种酯,则丁与醋酸在催化剂作用下发生取代反应生成的酯有3种,故答案为:3;
1种酯,则丁与醋酸在催化剂作用下发生取代反应生成的酯有3种,故答案为:3;
(4)①在浓硫酸作用下,甲与乙醇共热发生酯化反应生成![]() 和水,反应的化学方程式为
和水,反应的化学方程式为![]() +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O,故答案为:
+H2O,故答案为:![]() +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O;
+H2O;
②乙含有醛基,碱性条件下,乙与新制氢氧化铜悬浊液共热反应生成![]() 、Cu2O砖红色沉淀和H2O,反应的化学方程式为
、Cu2O砖红色沉淀和H2O,反应的化学方程式为![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O,故答案为:
+Cu2O↓+3H2O,故答案为:![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O。
+Cu2O↓+3H2O。

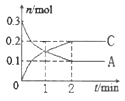
【题目】一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1·min1
B. 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C. 该温度,反应的平衡常数为11.25L·mol-1
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
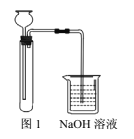
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:H2C2O4是弱电解质)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是( )
A.H2C2O4有酸性:Ca(OH)2+ H2C2O4=CaC2O4↓+2H2O
B.酸性H2C2O4> H2CO3:NaHCO3+ H2C2O4=NaHC2O4+CO2↑+H2O
C.H2C2O4具有还原性:2![]() +5
+5![]() +16H+=2Mn2++10CO2↑+ 8H2O
+16H+=2Mn2++10CO2↑+ 8H2O
D.H2C2O4可发生酯化反应:HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O