题目内容
钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式: .
(2)图1中可防止铁棒被腐蚀装置是 .

(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置示意图如图2:请回答:
①A电极对应的金属是 (写元素名称),B电极的电极反应式是 .
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 .
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
(2)图1中可防止铁棒被腐蚀装置是

(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置示意图如图2:请回答:
①A电极对应的金属是
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:(1)一氧化碳具有还原性可以还原氧化铁生成铁和二氧化碳;
(2)根据金属生锈的条件以及原电池和电解池的工作原理知识来回答判断;
(3)①在铁件的表面镀铜时,金属铜必须是阳极材料,金属铁为阴极,根据电解池的工作原理来回答;
②在原电池中,负极金属易被腐蚀,正极上的金属被保护.
(2)根据金属生锈的条件以及原电池和电解池的工作原理知识来回答判断;
(3)①在铁件的表面镀铜时,金属铜必须是阳极材料,金属铁为阴极,根据电解池的工作原理来回答;
②在原电池中,负极金属易被腐蚀,正极上的金属被保护.
解答:
解:(1)一氧化碳具有还原性,一氧化碳可以还原氧化铁生成铁和二氧化碳,化学方程为:3CO+Fe2O3
3CO2+2Fe;
故答案为:3CO+Fe2O3
3CO2+2Fe;
(2)B装置中,金属铁做原电池的正极,被保护,不易生锈,D装置中,金属铁作阴极,被保护起来,C装置具备金属生锈的条件,A装置中,金属铁是原电池的负极,易被腐蚀,故答案为:BD;
(3)①在铁件的表面镀铜,金属铜必须是阳极材料,发生电极本身失电子的氧化反应,且金属铁为阴极,则B发生电极反应:Cu2++2e-=Cu,
故答案为:铜;Cu2++2e-=Cu;
②镀铜铁中由于铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀,但是镀锌的铁镀层破损后,金属Zn为负极,金属铁为正极,正极金属被保护,
故答案为:铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀.
| ||
故答案为:3CO+Fe2O3
| ||
(2)B装置中,金属铁做原电池的正极,被保护,不易生锈,D装置中,金属铁作阴极,被保护起来,C装置具备金属生锈的条件,A装置中,金属铁是原电池的负极,易被腐蚀,故答案为:BD;
(3)①在铁件的表面镀铜,金属铜必须是阳极材料,发生电极本身失电子的氧化反应,且金属铁为阴极,则B发生电极反应:Cu2++2e-=Cu,
故答案为:铜;Cu2++2e-=Cu;
②镀铜铁中由于铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀,但是镀锌的铁镀层破损后,金属Zn为负极,金属铁为正极,正极金属被保护,
故答案为:铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀.
点评:本题考查学生原电池和电解池的工作原理以及金属的腐蚀和防护知识,注意知识的归纳和整理是解题关键,难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、一定温度下,将盐酸滴加入醋酸钠溶液中至呈中性.此时溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
| B、常温下,将0.1 mol?L-1氨水稀释10倍后,其pH大于12 |
| C、常温下,Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=4.9×10-5,则反应CaSO4(s)+CO32- (aq)═CaCO3(s)+SO42-(aq) 平衡常数K约为1.75×10-4 |
| D、溶有等物质的量的NaClO、NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c(H2CO3) |
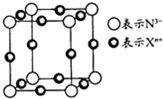 如图为某晶胞结构,其中Xn+中K、L、M三个电子层均填满电子,下列有关说法正确的是( )
如图为某晶胞结构,其中Xn+中K、L、M三个电子层均填满电子,下列有关说法正确的是( )| A、该晶体的化学式是Cu3N |
| B、Xn+离子中n=2 |
| C、X是第三周期元素 |
| D、在晶体中,N3-的配位数为3 |
 将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如图,符合图中情况的一组物质是( )
将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如图,符合图中情况的一组物质是( )
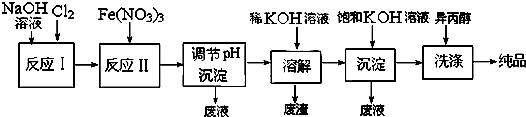
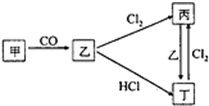 (已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末.它们之间有如图所示的转化关系(转化过程申部分产物未标出).
(已知甲、乙、丙、丁4种物质均含有常见金属元素A,其中甲为红棕色粉末.它们之间有如图所示的转化关系(转化过程申部分产物未标出).