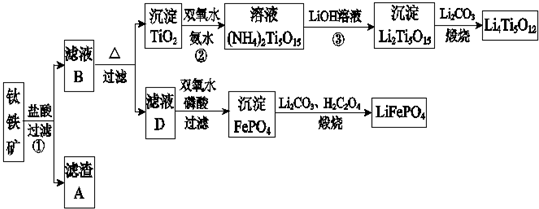
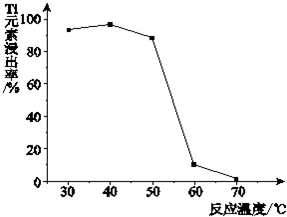
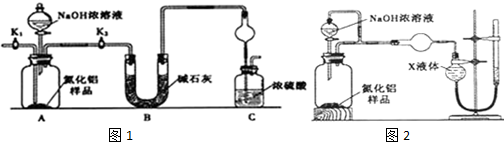
题目内容
10.以下指定反应的离子方程式书写正确的是( )| A. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | ||||||
| B. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,离子方程式为:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | ||||||
| C. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | ||||||
| D. | 碳酸和次氯酸的电离平衡常数见表,二氧化碳通入次氯酸钠溶液中:2NaClO+CO2+H2O═Na2CO3+2HClO
|
分析 A.反应生成硫酸钠、氧气;
B.反应生成等量的氢氧化铝、偏铝酸钠和水;
C.反应生成硫酸钠、氢氧化铜、氢气;
D.由Ka可知酸性强弱,发生强酸制取弱酸的反应.
解答 解:A.NaHSO3溶液中投入过氧化钠粉末的离子反应为4HSO3-+2Na2O2═4SO42-+O2↑+4Na+,故A错误;
B.AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,离子方程式为2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O,故B正确;
C.钠与CuSO4溶液反应的离子反应为2H2O+2Na+Cu2+═Cu(OH)2↓+H2↑+2Na+,故C错误;
D.碳酸和次氯酸的电离平衡常数见表,二氧化碳通入次氯酸钠溶液中的离子反应为NaClO+CO2+H2O═NaHCO3+HClO,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
5.如表实验操作正确且能达到预期目的是( )
| 实验目的 | 操作 | |
| A | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液 |
| B | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| C | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| D | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| A. | A | B. | B | C. | C | D. | D |
15.下列各组离子在指定溶液中均能大量共存的是( )
| A. | 含有大量Fe2+的溶液:Na+、SO42+、NH4+、Fe(CN)63- | |
| B. | 使甲基橙变红的溶液:NH4+、CH3COO一、SO42+、Mg2+ | |
| C. | 某无色溶液:OH一、K+、ClO一、Ba2+ | |
| D. | 含有大量NO3-的溶液:K+、I一、NH4+、H+ |
2.下列说法正确的是( )
| A. | 工业上生产玻璃、水泥、漂白粉均需要用石灰石为原料 | |
| B. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 | |
| C. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| D. | 司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金 |
19. 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )| A. | HA为一元强酸,MOH为一元弱碱 | |
| B. | 滴入MOH溶液的体积为50 mL时,c(M+)>c(A-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点时,c(MOH)+c(M+)=0.02 mol•L-1 |
20.①25℃,两种酸的电离平衡常数如表.
HSO3-的电离平衡常数表达式K=$\frac{c(S{{O}_{3}}^{2-})c({H}^{+})}{c(HS{{O}_{3}}^{-})}$.
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
③根据H2SO3的电离常数数据,判断NaHSO3溶液显酸性还是显碱性?
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
③根据H2SO3的电离常数数据,判断NaHSO3溶液显酸性还是显碱性?