题目内容
4.一定温度下,50mL0.4mol/L过氧化氢溶液在二氧化锰作用下发生分解,5min后测得过氧化氢溶液的浓度为0.2mol/L,请计算:(溶液体积变化忽略不计)(1)5min内过氧化氢的分解速率.
(2)5min内过氧化氢分解的转化率.
(3)5min内生成的气体在标准状况下的体积.
分析 过氧化氢分解反应的方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2,
(1)计算出过氧化氢的浓度变化,然后根据c=$\frac{△c}{△t}$计算出过氧化氢的分解速率;
(2)根据$\frac{过氧化氢的消耗浓度}{总浓度}$×100%计算出过氧化氢的转化率;
(3)根据n=cV计算出过氧化氢消耗的物质的量,然后根据反应方程式计算出生成氧气的物质的量,最后根据V=nVm计算出生成标准状况下氧气的体积.
解答 解:(1)5min后测得过氧化氢溶液的浓度为0.2mol/L,则5min内过氧化氢的平均分解速率为:$\frac{0.4mol/L-0.2mol/L}{5min}$=0.04mol/(L•min),
答:5min内过氧化氢的分解速率为0.04mol/(L•min);
(2)5min内过氧化氢的浓度变化为:0.4mol/L-0.2mol/L=0.2mol/L,则过氧化氢的分解转化率为:$\frac{0.2mol/L}{0.4mol/L}$×100%=50%,
答:5min内过氧化氢的分解转化率为50%;
(3)5min内过氧化氢的物质的量变化为:0.2mol/L×0.05L=0.01mol,根据反应2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2可知,0.01mol过氧化钠分解生成氧气的物质的量为:0.01mol$\frac{1}{2}$=0.005mol,
标准状况下0.005mol氧气的体积为:22.4L/mol×0.005mol=0.112L,
答:5min内生成标准状况下氧气的体积为0.112L.
点评 本题考查了化学平衡的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握化学反应速率、转化率的概念及表达式,试题培养了学生的分析能力及灵活应用能力.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | 0.1mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| B. | 0.1mol•L-1NaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.1mol•L-1CH3COOH溶液和0.1mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| A. | 它位于周期表的第四周期、第ⅠA族 | |
| B. | 在钠、钾、铷三种单质中,相同条件下铷与水的反应速率最小 | |
| C. | 氢氧化铷是弱碱 | |
| D. | 硝酸铷是离子化合物 |
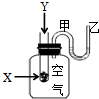 为了研究化学反应X+Y=Z的能量变化情况,某同学设计了如图所示装置.当向盛有X的试管中滴加试剂Y时,看到U型管中甲处液面下降乙处液面上升.试回答下列问题:
为了研究化学反应X+Y=Z的能量变化情况,某同学设计了如图所示装置.当向盛有X的试管中滴加试剂Y时,看到U型管中甲处液面下降乙处液面上升.试回答下列问题: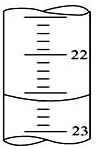 (I)、某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
(I)、某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:

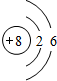 .
.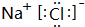 .
.