题目内容
(1)实验室在配制Al2(SO4)3溶液时,为了防止发生水解,可以加入少量 ;在配制Na2S溶液时,为了防止水解,可以加入少量 .
(2)3mol/L 100mL的H2SO4溶液与足量的Zn反应,为使产生的H2速率减慢,但产生H2的总量不变,可采取的措施是
A.加固体CH3COONa B.BaCl2溶液 C.NH4Cl溶液 D.加氨水.
(2)3mol/L 100mL的H2SO4溶液与足量的Zn反应,为使产生的H2速率减慢,但产生H2的总量不变,可采取的措施是
A.加固体CH3COONa B.BaCl2溶液 C.NH4Cl溶液 D.加氨水.
考点:盐类水解的应用,化学反应速率的影响因素
专题:化学反应速率专题,盐类的水解专题
分析:(1)铝离子水解生成氢氧化铝和氢离子,溶液呈酸性;加入硫酸会抑制铝离子的水解;在Na2S溶液中,硫离子是多元弱酸阴离子,水解分步进行;防止水解需要加入氢氧化钠溶液;
(2)减慢反应速率,可降低温度或浓度,产生的H2的总量不变,则氢离子的总物质的量不变;
(2)减慢反应速率,可降低温度或浓度,产生的H2的总量不变,则氢离子的总物质的量不变;
解答:
解:(1)在配制Al2(SO4)3溶液时,Al3+会部分水解而使溶液呈酸性,水解的离子方程式为Al3++3H2O?Al(OH)3+3H+;为了防止发生水解,可以加入少量的硫酸,在Na2S溶液中,硫离子是多元弱酸阴离子,水解分步进行,水解的离子方程式为:S2-+H2O?HS-+OH-;为了防止水解,在配制该溶液时,可以加入少量的氢氧化钠溶液中的氢氧根离子浓度抑制硫离子的水解;
故答案为:硫酸;NaOH溶液;
(2)A.加醋酸钠固体,生成醋酸为弱电解质,溶液氢离子浓度降低,反应速率减小,但生成氢气的总量不变,故A正确;
B.加BaCl2溶液,氢离子总量不变,应溶液总体积增大,氢离子浓度降低,反应速率减小,故B正确;
C.加NH4Cl溶液,氯化铵水解呈酸性,生成氢气的总量增大,故C错误;
D.加氨水,消耗酸,生成氢气总量减小,故D错误.
故答案为:AB;
故答案为:硫酸;NaOH溶液;
(2)A.加醋酸钠固体,生成醋酸为弱电解质,溶液氢离子浓度降低,反应速率减小,但生成氢气的总量不变,故A正确;
B.加BaCl2溶液,氢离子总量不变,应溶液总体积增大,氢离子浓度降低,反应速率减小,故B正确;
C.加NH4Cl溶液,氯化铵水解呈酸性,生成氢气的总量增大,故C错误;
D.加氨水,消耗酸,生成氢气总量减小,故D错误.
故答案为:AB;
点评:本题考查了盐类水解影响因素和平衡移动方向判断等知识点,根据盐类水解特点来分析解答,注意影响因素的理解应用,题目难度中等.

练习册系列答案
相关题目
下列事实与胶体性质无关的是( )
| A、硫酸铜溶液与氢氧化钠溶液反应生成氢氧化铜蓝色沉淀 |
| B、河流入海处易形成沙洲 |
| C、早晨阳光穿过茂密的林木枝叶产生的美丽景象 |
| D、在豆浆里加入盐卤做豆腐 |
下列物质:①NaCl ②HNO3 ③Cu(OH)2 ④NH3 ⑤AgNO3 ⑥H2O ⑦CH4 ⑧HClO
其中属于弱电解质的是( )
其中属于弱电解质的是( )
| A、②③⑥ | B、④⑤⑧ |
| C、③⑥⑧ | D、⑥⑧ |
下列说法正确的是( )
| A、Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性 |
| B、7.8gNa2O2与CO2完全反应,转移0.2mol电子 |
| C、能通过化合反应制得FeCl3和Fe(OH)3 |
| D、NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
下列说法不正确的是( )
| A、Mg的金属性比Al强 |
| B、H2S的热稳定性比H2O强 |
| C、Na的原子半径比N原子大 |
| D、HClO4的酸性比H3PO4强 |
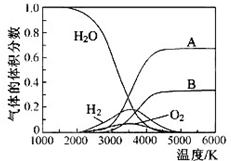 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.