题目内容
下列物质:①NaCl ②HNO3 ③Cu(OH)2 ④NH3 ⑤AgNO3 ⑥H2O ⑦CH4 ⑧HClO
其中属于弱电解质的是( )
其中属于弱电解质的是( )
| A、②③⑥ | B、④⑤⑧ |
| C、③⑥⑧ | D、⑥⑧ |
考点:强电解质和弱电解质的概念
专题:电离平衡与溶液的pH专题
分析:在水溶液或熔融状态下能够导电的化合物为电解质,在水溶液和熔融状态下都不能导电的化合物为非电解质;
在水溶液中能够完全电离的化合物为强电解质,部分电离的为弱电解质.
在水溶液中能够完全电离的化合物为强电解质,部分电离的为弱电解质.
解答:
解:①NaCl、②HNO3、⑤AgNO3 在水溶液中能够完全电离的属于强电解质;
③Cu(OH)2、⑥H2O、⑧HClO在水溶液中部分电离,属于弱电解质;
④NH3、⑦CH4 在水溶液和熔融状态下本身都不能电离,属于非电解质;
故选:C.
③Cu(OH)2、⑥H2O、⑧HClO在水溶液中部分电离,属于弱电解质;
④NH3、⑦CH4 在水溶液和熔融状态下本身都不能电离,属于非电解质;
故选:C.
点评:本题考查电解质强弱的判断,明确概念的要点是解题关键,电解质电离的程度是电解质强弱的判断依据,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
常温下,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A、在含有等物质的量浓度的CH3COOH和CH3COONa 混合溶液中:c(CH3COOH)+c(CH3COO-)=c(Na+) |
| B、在(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| C、等物质的量浓度的盐酸和醋酸两种溶液中:c(Cl-)=c(CH3COO-) |
| D、在NaHSO4溶液中:c(Na+)=c(SO42-) |
下列叙述中错误的是( )
| A、离子键没有方向性和饱和性,共价键有方向性和饱和性 |
| B、配位键在形成时,由成键双方各提供一个电子形成共用电子对 |
| C、金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用 |
| D、金属键中的“自由电子”为金属阳离子共用 |
下列说法正确的是( )
| A、6.02×1023个碳原子的质量为1g |
| B、钠原子的摩尔质量为23g |
| C、1molHCl的体积是22.4L |
| D、CO2的摩尔质量为44g?mol-1 |
从海水中提取部分物质的过程如图所示
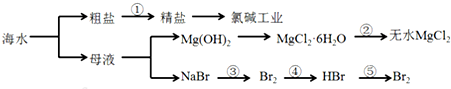
下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A、从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 |
| B、过程②中结晶出的MgCl2?6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C、经过③④实现了溴元素的富集 |
| D、电解MgCl2溶液制取Mg单质 |
下列说法正确的是( )
| A、氧的摩尔质量是32 g?mol-1 |
| B、CO32-摩尔质量是60 g/mol |
| C、CO2的相对分子质量是44g |
| D、硫酸的摩尔质量是98g |
下列物质中不能用于饮用水的杀菌消毒的是( )
| A、漂白粉 | B、二氧化氯 |
| C、甲醛 | D、氯气 |