题目内容
pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4:1的体积比混合,则溶液中c(H+)为(mol/L)( )
A、
| ||
B、
| ||
| C、5×10-10 | ||
| D、5×10-12 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:pH=9的Ba(OH)2溶液中c(OH-)=10-5mol?L-1,pH=12的KOH溶液c(OH-)=10-2mol?L-1,按4:1的体积比混合,首先求混合后氢氧根离子的浓度,然后再根据Kw=c(OH-)×c(H+)=10-14,可计算出c(H+).
解答:
解:pH=9的Ba(OH)2溶液中c(OH-)=10-5mol?L-1,pH=12的KOH溶液c(OH-)=10-2mol?L-1,按4:1的体积比混合后c(OH-)=
=2×10-3mol?L-1,c(H+)=
=
=5×10-12mol?L-1,
故选D.
| 4×10-5+1×10-2 |
| 5 |
| KW |
| C(OH-) |
| 1×10-14 |
| 2×10-3 |
故选D.
点评:本题考查pH的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握计算的相关公式的运用以及解题思路的梳理,难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
下列过程中,没有明显实验现象的是( )
| A、向饱和碳酸钠溶液通入CO2气体 |
| B、少量过氧化钠投入AlCl3溶液 |
| C、向碳酸氢钠溶液中滴加氢氧化钠溶液 |
| D、向Fe(NO3)2溶液中滴加稀硫酸 |
某离子化合物的晶胞如图所示立体结构,晶胞是整个晶体中最基本的重复单位.小黑球表示阳离子,小白球表示阴离子,该离子化合物中,阴、阳离子个数比是( )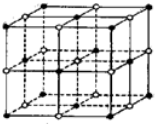

| A、1:8 | B、1:4 |
| C、1:2 | D、1:1 |
把0.05molNaOH固体分别加入到100mL液体中,溶液的导电能力变化不大的是( )
| A、自来水 |
| B、0.5mol?L-1醋酸 |
| C、0.5mol?L-1硝酸 |
| D、0.5mol?L-1氨水溶液 |
某元素在化学反应中由化合态变为游离态,则该元素( )
| A、一定被氧化了 |
| B、一定被还原了 |
| C、既可能被氧化也可能被还原 |
| D、既不可能被氧化,也不可能被还原 |
相同状态下,10体积A2气体和20体积B2气体化合成20体积气体C,则C的化学式为( )
| A、AB |
| B、A2B |
| C、AB3 |
| D、AB2 |
下列有关物质组成与结构表示方法不正确的是( )
A、HClO 电子式: | ||
B、CH4 比例模型: | ||
| C、乙炔结构简式:HC≡CH | ||
D、质子数55,中子数82的原子
|