题目内容
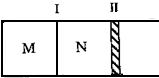 如图所示,隔板I固定不动,活塞II可自由移动.M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g);△H<0.若起始时,M、N容积相同.下列说法正确的是( )
如图所示,隔板I固定不动,活塞II可自由移动.M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g);△H<0.若起始时,M、N容积相同.下列说法正确的是( )| A、起始时,分别向M、N两个容器中加入1molA、1molB,达平衡时,容器M、N中物质A的体积分数相同 |
| B、起始时,分别向M、N两个容器中加入1molA、3molB,达平衡时,容器M中物质A的转化率较大 |
| C、起始时,分别向M、N两个容器中加入2molC,容器N达到平衡所需的时间较短 |
| D、起始时,分别向M、N两个容器中加入1molA、3molB,达到平衡时,容器M中气体的密度较小 |
考点:化学平衡的计算
专题:
分析:M为恒容、N为恒压,该反应是体积缩小的反应,所以N中的压强大于M,
A、由于压强不同,建立的平衡不同,达到平衡时A的体积分数不同;
B、由于N的压强大于M,压强增大,平衡向着正向移动,所以M中A的转化率较小;
C、压强越大,反应速率越快,达到平衡的时间越短,N反应速率快;
D、M的密度不变,而N为了保持恒压,所以体积缩小,气体的密度增大.
A、由于压强不同,建立的平衡不同,达到平衡时A的体积分数不同;
B、由于N的压强大于M,压强增大,平衡向着正向移动,所以M中A的转化率较小;
C、压强越大,反应速率越快,达到平衡的时间越短,N反应速率快;
D、M的密度不变,而N为了保持恒压,所以体积缩小,气体的密度增大.
解答:
解:由信息可知,M为恒容、N为恒压,该反应是体积缩小的反应,所以N中的压强大于M,
A、起始时,分别向M、N两个容器中加入1molA、1molB,由于M和N的反应条件不同,该反应又是体积缩小的反应,N中压强大于M,平衡向着正向移动,所以达平衡时,容器M中物质A的体积分数大于N,故A错误;
B、起始时,分别向M、N两个容器中加入1molA、3molB,N中压强比M大,压强增大,平衡向着正向移动,所以达平衡时,容器N中物质A的转化率大于M,故B错误;
C、起始时,分别向M、N两个容器中加入2molC,由于N的压强较大,反应速率较快,所以达到平衡需要的时间较短,故C正确;
D、起始时,分别向M、N两个容器中加入1molA、3molB,M的容积不变,反应两边都是气体,所以M中的密度不变;而N为了保持压强不变,容器的容积会变小,混合气体的密度增大,所以N中混合气体密度大于M,故D错误;
故选C.
A、起始时,分别向M、N两个容器中加入1molA、1molB,由于M和N的反应条件不同,该反应又是体积缩小的反应,N中压强大于M,平衡向着正向移动,所以达平衡时,容器M中物质A的体积分数大于N,故A错误;
B、起始时,分别向M、N两个容器中加入1molA、3molB,N中压强比M大,压强增大,平衡向着正向移动,所以达平衡时,容器N中物质A的转化率大于M,故B错误;
C、起始时,分别向M、N两个容器中加入2molC,由于N的压强较大,反应速率较快,所以达到平衡需要的时间较短,故C正确;
D、起始时,分别向M、N两个容器中加入1molA、3molB,M的容积不变,反应两边都是气体,所以M中的密度不变;而N为了保持压强不变,容器的容积会变小,混合气体的密度增大,所以N中混合气体密度大于M,故D错误;
故选C.
点评:本题考查了影响化学平衡的因素,题目难度中等,注意影响化学平衡的因素,解题关键是分析M和N中反应条件及该反应方程式两边气体的体积变化,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题能力.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案
相关题目
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS).下列分析正确的是( )
| A、CuS的溶解度大于PbS的溶解度 |
| B、原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| C、CuSO4与ZnS反应的离子方程式是Cu2++ZnS→CuS+Zn2+ |
| D、整个过程涉及的反应类型只有氧化还原反应 |
日常生活中的一些小窍门或小常识往往包含一些化学原理.下列做法正确的是( )
①煤气泄漏时打开换气扇排气 ②眼睛里不小心溅进氢氧化钠溶液,立即滴稀盐酸来中和 ③修车工用汽油洗手上的油污 ④月饼盒中放入装有铁粉的小包装,可以防止月饼变质.
①煤气泄漏时打开换气扇排气 ②眼睛里不小心溅进氢氧化钠溶液,立即滴稀盐酸来中和 ③修车工用汽油洗手上的油污 ④月饼盒中放入装有铁粉的小包装,可以防止月饼变质.
| A、①② | B、②③ | C、②④ | D、③④ |
将4.6g金属钠溶解在95.4g水中,所得溶液溶质的质量分数是( )
| A、等于7.8% |
| B、大于8% |
| C、等于 8% |
| D、小于 7.8% |
被称为万能还原剂的NaBH4(NaBH4中H为-1价)能溶于水并和水反应,有如下反应NaBH4+2H2O=NaBO2+4H2↑,下列有关该反应的说法中,正确的是( )
| A、NaBH4既是氧化剂又是还原剂 |
| B、NaBH4是氧化剂,H2O是还原剂 |
| C、硼元素被氧化,氢元素被还原 |
| D、被氧化的元素与被还原的元素质量比为1:1 |
 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化. 甲、乙、丙、丁四种物质转化关系如图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.
甲、乙、丙、丁四种物质转化关系如图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.