题目内容
在500mL0.2mol?L-1的稀硝酸中加入1.92克铜片,让其充分反应.试求.
(1)写出反应的化学方程式 ,
(2)产生的气体在标准状况下占的体积为 L
(3)反应后溶液中H+的物质的量浓度是 mol/L
(4)反应后溶液中NO3-的物质的量浓度是 mol/L
(5)若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入0.2mol/L的氢氧化钠溶 毫升.
(1)写出反应的化学方程式
(2)产生的气体在标准状况下占的体积为
(3)反应后溶液中H+的物质的量浓度是
(4)反应后溶液中NO3-的物质的量浓度是
(5)若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入0.2mol/L的氢氧化钠溶
考点:化学方程式的有关计算
专题:
分析:(1)铜和稀硝酸反应生成硝酸铜和水和一氧化氮;
(2)根据方程式计算生成一氧化氮物质的量根据V=n×Vm计算;
(3)根据方程式计算消耗的硝酸,用原由硝酸减去消耗的即为剩余的硝酸;
(4)根据消耗的硝酸根转变为一氧化氮气体解答;
(5)根据氢离子和Cu2+都消耗氢氧根离子,求出氢氧化钠溶液的体积.
(2)根据方程式计算生成一氧化氮物质的量根据V=n×Vm计算;
(3)根据方程式计算消耗的硝酸,用原由硝酸减去消耗的即为剩余的硝酸;
(4)根据消耗的硝酸根转变为一氧化氮气体解答;
(5)根据氢离子和Cu2+都消耗氢氧根离子,求出氢氧化钠溶液的体积.
解答:
解:(1)铜和稀硝酸发生氧化还原反应3Cu+8HNO3(稀) =3Cu(NO3)2+4H2O+2NO↑,
故答案为:3Cu+8HNO3(稀) =3Cu(NO3)2+4H2O+2NO↑;
(2)n(Cu)=
=0.03mol,n(HNO3)=V?c=0.5L×0.2 mol?L-1=0.1 mol,
由3Cu+8HNO3 =3Cu(NO3)2+4H2O+2NO↑可知,稀硝酸过量,
设生成的一氧化氮物质的量为x,则
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
3 2
0.03mol x
生成NO的物质的量x=
=0.02mol,标准状况下所占的体积为V=n×Vm=0.02mol×22.4L/mol=0.448L,
故答案为:0.448;
(3)设消耗硝酸的物质的量y
3Cu+8HNO3 =3Cu(NO3)2 +2NO↑+4H2O
3 8
0.03mol y
消耗硝酸的物质的量y=
=0.08mol,则反应后溶液中H+的物质的量浓度是C=
=
=0.04mol/L,
故答案为:0.04;
(4)500mL0.2mol?L-1的稀硝酸中n(NO3-)=0.1mol,由3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知,生成0.02molNO时消耗0.02mol硝酸根离子,反应后溶液中NO3-的物质的量为0.1mol-0.02mol=0.08mol,反应后溶液中NO3-的物质的量浓度是C=
=
=0.16mol/L,
故答案为:0.16;
(5)因剩余的氢离子需要0.02mol氢氧根离子中和,每1mol铜离子需要2mol氢氧根离子转化成氢氧化铜沉淀,这需要0.06mol氢氧根,所以一共需要的氢氧根离子0.02+0.06=0.08mol,
也就是0.08mol氢氧化钠氢氧化钠体积为V=
=
=0.4L=400ml
故答案为:400.
故答案为:3Cu+8HNO3(稀) =3Cu(NO3)2+4H2O+2NO↑;
(2)n(Cu)=
| 1.92g |
| 64g/mol |
由3Cu+8HNO3 =3Cu(NO3)2+4H2O+2NO↑可知,稀硝酸过量,
设生成的一氧化氮物质的量为x,则
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
3 2
0.03mol x
生成NO的物质的量x=
| 2×0.03mol |
| 3 |
故答案为:0.448;
(3)设消耗硝酸的物质的量y
3Cu+8HNO3 =3Cu(NO3)2 +2NO↑+4H2O
3 8
0.03mol y
消耗硝酸的物质的量y=
| 0.03mol×8 |
| 3 |
| n |
| v |
| 0.1mol-0.08mol |
| 0.5L |
=0.04mol/L,
故答案为:0.04;
(4)500mL0.2mol?L-1的稀硝酸中n(NO3-)=0.1mol,由3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知,生成0.02molNO时消耗0.02mol硝酸根离子,反应后溶液中NO3-的物质的量为0.1mol-0.02mol=0.08mol,反应后溶液中NO3-的物质的量浓度是C=
| n |
| v |
| 0.08mol |
| 0.5L |
故答案为:0.16;
(5)因剩余的氢离子需要0.02mol氢氧根离子中和,每1mol铜离子需要2mol氢氧根离子转化成氢氧化铜沉淀,这需要0.06mol氢氧根,所以一共需要的氢氧根离子0.02+0.06=0.08mol,
也就是0.08mol氢氧化钠氢氧化钠体积为V=
| n |
| C |
| 0.08mol |
| 0.2mol/L |
故答案为:400.
点评:本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意硝酸的性质、化学计算中的过量判断以及守恒法的运用,题目难度中等.

练习册系列答案
相关题目
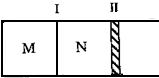 如图所示,隔板I固定不动,活塞II可自由移动.M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g);△H<0.若起始时,M、N容积相同.下列说法正确的是( )
如图所示,隔板I固定不动,活塞II可自由移动.M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g);△H<0.若起始时,M、N容积相同.下列说法正确的是( )| A、起始时,分别向M、N两个容器中加入1molA、1molB,达平衡时,容器M、N中物质A的体积分数相同 |
| B、起始时,分别向M、N两个容器中加入1molA、3molB,达平衡时,容器M中物质A的转化率较大 |
| C、起始时,分别向M、N两个容器中加入2molC,容器N达到平衡所需的时间较短 |
| D、起始时,分别向M、N两个容器中加入1molA、3molB,达到平衡时,容器M中气体的密度较小 |
下列有机反应中,能够实现的是( )
A、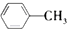 +Cl2 +Cl2
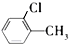 +HCl +HCl | |||
B、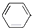 +CH2═CH-CH3 +CH2═CH-CH3
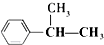 | |||
C、ClCH2CH2CH3+NaOH
| |||
D、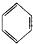 +2HONO2 +2HONO2
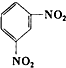 +2H2O +2H2O |
下列反应中,反应物总能量低于生成物总能量的是(( )
| A、C+CO2=2CO |
| B、C+O2=CO2 |
| C、2C+O2=2CO |
| D、C+CuO=CO2+Cu |
以下各组离子能在给定的四种溶液中大量共存的是( )
| A、加入铁粉产生大量气体的溶液:Cu2+、Na+、Mg2+、NO3- |
| B、滴加酚酞显红色的溶液:Fe3+、NH4+、Cl-、NO3- |
| C、无色透明溶液:K+、SO42-、NO3-、OH- |
| D、碱性溶液:K+、HCO3-、Cl-、Ba2+ |