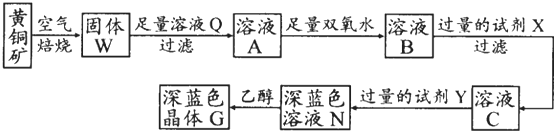
题目内容
将4.6g金属钠溶解在95.4g水中,所得溶液溶质的质量分数是( )
| A、等于7.8% |
| B、大于8% |
| C、等于 8% |
| D、小于 7.8% |
考点:溶液中溶质的质量分数及相关计算
专题:
分析:根据n=
计算出金属钠的物质的量,然后根据反应方程式2Na+2H2O=2NaOH+H2↑计算出生成氢氧化钠的物质的量,再根据m=nM计算出溶质氢氧化钠的质量,再根据溶质质量、溶液质量判断溶液质量分数.
| m |
| M |
解答:
解:4.6g金属钠的物质的量为:
=0.2mol,
根据反应2Na+2H2O=2NaOH+H2↑可知,生成溶质氢氧化钠的物质的量为0.2mol,
氢氧化钠的质量为:40g/mol×0.2mol=8g
4.6g金属钠和95.4g水的质量为100g,由于反应生成氢气,则反应后溶液的质量小于100g,
根据ω=
×100%可知,所带溶液质量分数一定大于8%,
故选B.
| 4.6g |
| 23g/mol |
根据反应2Na+2H2O=2NaOH+H2↑可知,生成溶质氢氧化钠的物质的量为0.2mol,
氢氧化钠的质量为:40g/mol×0.2mol=8g
4.6g金属钠和95.4g水的质量为100g,由于反应生成氢气,则反应后溶液的质量小于100g,
根据ω=
| m溶质 |
| m溶液 |
故选B.
点评:本题考查了有关反应方程式的计算,题目难度不大,试题侧重基础知识的考查,明确反应原理为解答关键,注意反应中有氢气生成,反应后的溶液质量小于100g,溶质质量分数大于8%.

练习册系列答案
相关题目
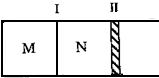 如图所示,隔板I固定不动,活塞II可自由移动.M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g);△H<0.若起始时,M、N容积相同.下列说法正确的是( )
如图所示,隔板I固定不动,活塞II可自由移动.M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g);△H<0.若起始时,M、N容积相同.下列说法正确的是( )| A、起始时,分别向M、N两个容器中加入1molA、1molB,达平衡时,容器M、N中物质A的体积分数相同 |
| B、起始时,分别向M、N两个容器中加入1molA、3molB,达平衡时,容器M中物质A的转化率较大 |
| C、起始时,分别向M、N两个容器中加入2molC,容器N达到平衡所需的时间较短 |
| D、起始时,分别向M、N两个容器中加入1molA、3molB,达到平衡时,容器M中气体的密度较小 |
下列仪器和装置,用橡胶管经过简单连接,可制备收集多种不同的气体(暂不考虑尾气吸收).关于这些装置的接,下列说法正确的是( )
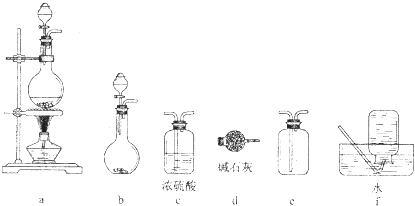

| A、制备收集C2H4:连接a→d→f |
| B、制备收集NO2:连接a→c→f |
| C、制备收集Cl2:连接a→d→e |
| D、制备收集NH3:连接b→→e |
碘是人和动物体内合成下列哪种激素的原料( )
| A、生长激素 | B、甲状腺激素 |
| C、胰岛素 | D、性激素 |
有关淀粉的叙述中正确的是( )
| A、淀粉的分子式是C6H12O6 |
| B、淀粉可以发生银镜反应 |
| C、淀粉可以直接检验食盐中是否含有碘元素 |
| D、淀粉是天然高分子化合物 |
下列有机反应中,能够实现的是( )
A、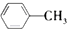 +Cl2 +Cl2
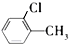 +HCl +HCl | |||
B、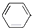 +CH2═CH-CH3 +CH2═CH-CH3
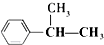 | |||
C、ClCH2CH2CH3+NaOH
| |||
D、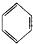 +2HONO2 +2HONO2
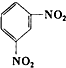 +2H2O +2H2O |
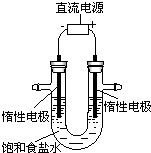 电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集Cl2小于2 L,原因是
电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集Cl2小于2 L,原因是