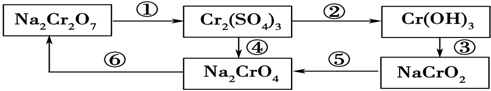
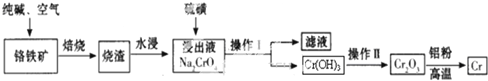
题目内容
已知NH4CuSO3与足量的2mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.据此判断下列说法正确的是( )
| A、反应中硫酸作氧化剂 |
| B、NH4CuSO3中硫元素被氧化 |
| C、1mol NH4CuSO3完全反应转移0.5mol电子 |
| D、刺激性气味的气体是氨气 |
考点:化学方程式的有关计算,浓硫酸的性质
专题:
分析:NH4CuSO3与硫酸混合微热,生成红色固体物、产生有刺激性气味的气体和蓝色溶液,说明反应生成Cu、SO2和Cu2+,反应的发产生为2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+,以此解答该题.
解答:
解:反应的发产生为:2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+,
A.由发产生为:2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+,反应只有Cu元素的化合价发生变化,硫酸根反应前后未变,反应中硫酸体现酸性,故A错误;
B.NH4CuSO3与硫酸混合微热,生成红色固体物、产生有刺激性气味的气体和蓝色溶液,说明反应生成Cu、SO2和Cu2+,反应前后S元素的化合价没有发生变化,故B错误;
C.反应只有Cu元素的化合价发生变化,分别由+1→+2,+1→0,每2molNH4CuSO3参加反应则转移1mol电子,则1molNH4CuSO3完全反应转移0.5mol电子,故C正确;
D.因反应是在酸性条件下进行,不可能生成氨气,故D错误,
故选:C.
A.由发产生为:2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+,反应只有Cu元素的化合价发生变化,硫酸根反应前后未变,反应中硫酸体现酸性,故A错误;
B.NH4CuSO3与硫酸混合微热,生成红色固体物、产生有刺激性气味的气体和蓝色溶液,说明反应生成Cu、SO2和Cu2+,反应前后S元素的化合价没有发生变化,故B错误;
C.反应只有Cu元素的化合价发生变化,分别由+1→+2,+1→0,每2molNH4CuSO3参加反应则转移1mol电子,则1molNH4CuSO3完全反应转移0.5mol电子,故C正确;
D.因反应是在酸性条件下进行,不可能生成氨气,故D错误,
故选:C.
点评:本题考查氧化还原反应,难度中等,注意从反应现象判断生成物,结合化合价的变化计算电子转移的数目.

练习册系列答案
相关题目
用价层电子对互斥模型预测下列粒子的立体结构是三角锥形的是( )
| A、PCl3 |
| B、BeCl2 |
| C、NH4+ |
| D、SO2 |
下列常用实验仪器中,不能直接用于混合物的分离或提纯的是( )
| A、分液漏斗 | B、漏斗 |
| C、蒸馏烧瓶 | D、容量瓶 |
下列可证明甲烷分子是正四面体结构的是( )
| A、一氯甲烷没有同分异构体 |
| B、二氯甲烷没有同分异构体 |
| C、三氯甲烷没有同分异构体 |
| D、甲烷分子的四个键完全相同 |
在1828年,德国化学键Wohler通过蒸发一种无机盐的水溶液,得到了有机物尿素CO(NH2)2.这一成果被称为有机化学发展史上的里程碑,Wohler使用的无机盐是( )
| A、NH4CNO |
| B、(NH4)2CO3 |
| C、CH3COONH4 |
| D、NH4NO3 |