题目内容
5.“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).请回答下列问题:(1)钠、钾着火,下列可用来灭火的是C.
A.水 B.干冰 C.细沙 D.泡沫灭火器
(2)白磷有毒能和氯酸溶液发生氧化还原反应:3P4+10HClO3+18H2O=10HCl+12H3PO4,该反应的氧化剂是HClO3,氧化产物是H3PO4,若有1mol P4参加反应转移电子为20mol.
(3)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,也可能发生氧化还原反应,下列反应一定不可能发生的是C.
A.NH4NO3→N2+O2+H2O B.NH4NO3→NH3+HNO3
C.NH4NO3→O2+HNO3+H2O D.NH4NO3→N2+HNO3+H2O
(4)NaCN属于剧毒物质,有多种无害化处理方法.
①H2O2处理法:NaCN+H2O2-N2↑+X+H2O,推测X的化学式为NaHCO3.
②以TiO2为催化剂用NaClO将CN-氧化成为CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等.取浓缩后含CN-的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol•L-1)进行实验.写出CNO-在酸性条件下被NaClO氧化的离子方程式2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O,若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为80%.
分析 (1)Na、K能和水反应生成氢气,在氧气中燃烧生成过氧化物,过氧化钠和水、二氧化碳反应都生成氧气,促进钠、钾燃烧;
(2)该反应中,P元素化合价由0价变为+5价、Cl元素化合价由+5价变为-1价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物;
若有1mol P4参加反应转移电子物质的量=1mol×4×(5-0);
(3)氧化还原反应中有化合价升高的元素也有化合价降低的元素;
(4)①根据元素守恒确定X中元素,根据转移电子守恒、原子守恒确定X化学式;
②根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,根据氧化还原反应配平;
干燥管Ⅰ中碱石灰增重1.408g为二氧化碳的质量,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2),原溶液中CN-的物质的量为0.2L×0.2mol/L=0.04mol,据此计算.
解答 解:(1)Na、K能和水反应生成氢气,在氧气中燃烧生成过氧化物,过氧化钠和水、二氧化碳反应都生成氧气,促进钠、钾燃烧,所以应该采用细沙灭火,故选C;
(2)该反应中,P元素化合价由0价变为+5价、Cl元素化合价由+5价变为-1价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,所以氯酸是氧化剂、磷酸是氧化产物;
若有1mol P4参加反应转移电子物质的量=1mol×4×(5-0)=20mol;
故答案为:HClO3;H3PO4;20;
(3)氧化还原反应中有化合价升高的元素也有化合价降低的元素,
A.NH4NO3→N2+O2+H2O中N元素化合价降低、O元素化合价升高,符合氧化还原反应,故A不选;
B.NH4NO3→NH3+HNO3中各元素化合价不变,符合复分解反应条件,故B不选;
C.NH4NO3→O2+HNO3+H2O中只有O元素化合价升高,所以不符合氧化还原反应,故C选;
D.NH4NO3→N2+HNO3+H2O中N元素有化合价升高的也有化合价降低的,符合氧化还原反应,故D不选;
故选C;
(4)①根据元素守恒知,X中含有Na、C元素,该反应中N元素化合价由-3价转化为0价、NaCN中C元素化合价为+2价,则C元素化合价由+2价转化为+4价,转移电子数为6,根据转移电子守恒、原子守恒知X为NaHCO3,
故答案为:NaHCO3;
②根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,反应离子方程式为2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O,
干燥管Ⅰ中碱石灰增重1.408g为二氧化碳的质量,物质的量为$\frac{1.408g}{44g/mol}$=0.032mol,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2)=0.032mol,原溶液中CN-的物质的量为0.2L×0.2mol/L=0.04mol,所以该实验中测得CN-被处理的百分率为$\frac{0.032mol}{0.04mol}$×100%=80%,
故答案为:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;80%.
点评 本题考查较综合,涉及化学方程式的计算、氧化还原反应方程式配平、物质性质等知识点,为高频考点,明确各个物理量之间关系是解本题关键,注意NaCN中C、N元素化合价分别是+2价、-3价,为易错点.

 全能练考卷系列答案
全能练考卷系列答案| A. | Na浮在水面上 | B. | Na在水面上游动 | ||
| C. | Na沉在水面下 | D. | Na熔成光亮的小球 |
| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | Mg(NO3)2═Mg2++2NO3- | D. | Na2SO4═2Na++SO42- |
| 组合分类 | 碱 | 酸 | 纯净物 | 碱性氧化物 | 酸性氧化物 |
| A | 纯碱 | H2SO4 | 冰水混合物 | Na2O2 | SO3 |
| B | NaOH | HCl | 冰醋酸 | Na2O | CO2 |
| C | NaOH | CH3COOH | 烧碱 | CO | SO2 |
| D | KOH | HNO3 | 干冰 | CaO | CO |
| A. | A | B. | B | C. | C | D. | D |
| A. | 华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅 | |
| B. | 汽油、漂白粉、水玻璃、王水均为混合物 | |
| C. | “静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 | |
| D. | 包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 |
| A. | 56 | B. | 56 g•mol-1 | C. | 28 | D. | 28 g•mol -1 |

| A. | t1℃时,100gKNO3饱和溶液中含有20g KNO3 | |
| B. | NaCl的溶解度不受温度的影响 | |
| C. | 温度高于t2℃时,KNO3的溶解度大于NaCl的溶解度 | |
| D. | t2℃时,KNO3的饱和溶液和NaCl的饱和溶液中溶质的质量分数不一定相等 |
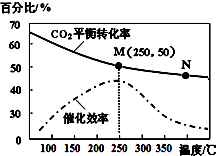 一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )| A. | 该反应的逆反应为吸热反应 | |
| B. | 平衡常数:KM>KN | |
| C. | 生成乙烯的速率:v(N)一定大于v(M) | |
| D. | 当温度高于250℃,升高温度,催化剂的催化效率降低 |