题目内容
14.按要求填空:(1)写出制取氢氧化铁胶体的水解方程式:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+
(2)有4中混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①CH3COONa与HCl
②CH3COONa与NaOH③CH3COONa与NaCl④CH3COONa与NaHCO3,则c(CH3COO-)从大到小的关系为②>④>③>①.(填序号).
(3)25℃时,已知0.1mol•L-1 CH3COONa溶液的pH=8,精确表达下列算式的数学结果:
①c(Na+)-c(CH3COO-)=(10-6-10-8)mol/L;
②c(OH-)-c(CH3COOH)=10-8mol/L
(4)若往Mg(OH)2的悬浊液中逐滴滴入NH4Cl溶液至澄清,该过程中沉淀溶解的离子反应是Mg(OH)2(s)+2NH4+(aq)=Mg2+(aq)+2NH3•H2O(aq).
分析 (1)三氯化铁浓溶液滴入沸水中,生成氢氧化铁胶体和H+;
(2)②中碱中的OH-抑制CH3COO-水解,④中两种盐相互抑制水解,③中只有水解,而①中CH3COO-与酸结合生成弱电解质,据此判断c(CH3C00-)的大小;
(3)分别根据醋酸钠溶液中的电荷守恒和物料守恒计算;
(4)铵根离子与氢氧化镁电离出的氢氧根离子结合生成一水合氨,促进了氢氧化镁的溶解.
解答 解:(1)三氯化铁浓溶液滴入沸水中,铁离子水解生成氢氧化铁胶体和H+,反应的离子方程式为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,
故答案为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+;
(2)因②中碱中的OH-抑制CH3COO-水解,则c(CH3C00-)最大,④中两种盐相互抑制水解,③中只有水解,而①中CH3COO-与酸结合生成弱电解质,则c(CH3C00-)最小,即c(CH3C00-)浓度大小为:②>④>③>①,
故答案为:②>④>③>①;
(3)①溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=$\frac{1{0}^{-14}}{1{0}^{-8}}$mol/L-10-8 mol/L=(10-6-10-8)mol/L,
故答案为:(10-6-10-8)mol/L;
②溶液中存在物料守恒c(Na+)=c(CH3COO-)+c(CH3COOH),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(H+)+c(CH3COOH)=c(OH-),则c(OH-)-c(CH3COOH)=c(H+)=10-8mol/L,
故答案为:10-8mol/L;
(4)氢氧化镁在原子存在溶解平衡,往Mg(OH)2的悬浊液中逐滴滴入NH4Cl溶液后,铵根离子结合氢氧根离子,氢氧化镁的溶解平衡向着正向移动,导致氢氧化镁溶解,反应的化学方程式为:Mg(OH)2(s)+2NH4+(aq)=Mg2+(aq)+2NH3•H2O(aq),
故答案为:Mg(OH)2(s)+2NH4+(aq)=Mg2+(aq)+2NH3•H2O(aq).
点评 本题考查了离子浓度大小的比较等知识点,题目难度中等,明确弱电解质电离及盐类水解特点是解本题关键,再结合物料守恒、电荷守恒确定离子浓度大小,难点是离子浓度大小比较.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 开发废旧电池综合利用技术,防止其中重金属盐对土壤水资源造成污染 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 低碳生活就是节能减排,使用太阳能等代替化石燃料,可减少温室气体的排放 | |
| D. | 光导纤维是以二氧化硅为主要原料制成的 |
| A. | 甲和乙一定是同分异构体 | |
| B. | 甲和乙不可能是同系物 | |
| C. | 甲和乙各1mol完全燃烧后,生成的二氧化碳的质量一定相等 | |
| D. | 甲和乙的分子中,碳、氢原子个数之比相同 |
| A. | 碘元素 | B. | 铁元素 | C. | 钾元素 | D. | 锌元素 |
| 组号 | 反应温度 (℃) | 参加反应的物质 | H2O体积(mL) | |||
| Na2S2O3 | H2SO4 | |||||
| 体积(mL) | 浓度(mol.L-1) | 体积(mL) | 浓度(mol.L-1) | |||
| A | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
| A. | A | B. | B | C. | C | D. | D |
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,a中液体立即沸腾,并有红棕色蒸气出现;a中发生反应的化学方程式为:2Fe+3Br2═2FeBr3、
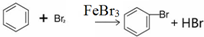 ;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.
;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是吸收其中的水分.
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C.
A.重结晶 B.过滤 C.蒸馏 D.萃取.
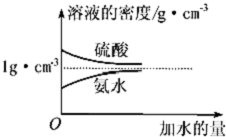 按要求完成下列填空:
按要求完成下列填空: