题目内容
(1)相同的物质的量浓度的NH4HSO4和(NH4)2SO4溶液,都显 性,前者显此性的主要原因是 ,后者显此性的主要原因是(用方程式表示)
(2)检验Na2CO3溶液中混有少量的NaOH,最好的方法是: .
(2)检验Na2CO3溶液中混有少量的NaOH,最好的方法是:
考点:盐类水解的应用,物质的检验和鉴别的基本方法选择及应用
专题:物质检验鉴别题,基本概念与基本理论
分析:(1)NH4HSO4的电离方程式:NH4HSO4=NH4++H++SO42-,电离显强酸性;(NH4)2SO4是强酸弱碱盐,水解显酸性,根据水解反应写出离子方程式;
(2)由于CO32-水解显碱性,故要证明NaOH的存在,必须先除去CO32-.
(2)由于CO32-水解显碱性,故要证明NaOH的存在,必须先除去CO32-.
解答:
解:(1)NH4HSO4是强电解质,能完全电离,电离方程式:NH4HSO4=NH4++H++SO42-,同时NH4+也能水解,但以电离出的H+为主,电离使得其溶液显强酸性;(NH4)2SO4是强酸弱碱盐,水解显酸性,水解的离子方程式:NH4++H2O?NH3?H2O+H+;故答案为:酸;NH4HSO4是强电解质,能完全电离:NH4HSO4=NH4++H++SO42-;NH4++H2O?NH3?H2O+H+;
(2)由于CO32-水解显碱性,故要证明NaOH的存在,必须先除去CO32-,故最好的检验方法是:先向溶液中加入足量的BaCl2溶液,再滴加酚酞溶液,溶液显红色说明含NaOH,故答案为:先向溶液中加入足量的BaCl2溶液,再滴加酚酞溶液,溶液显红色说明含NaOH.
(2)由于CO32-水解显碱性,故要证明NaOH的存在,必须先除去CO32-,故最好的检验方法是:先向溶液中加入足量的BaCl2溶液,再滴加酚酞溶液,溶液显红色说明含NaOH,故答案为:先向溶液中加入足量的BaCl2溶液,再滴加酚酞溶液,溶液显红色说明含NaOH.
点评:本题考查了盐类水解的应用,注意盐类的水解原理以及水解方程式的书写,难度不大.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
欲配制100mL 1.0mol?L-1 Na2SO4溶液,正确的方法是( )
| A、将14.2 g Na2SO4溶于100 mL水中 |
| B、将14.2 g Na2SO4?10H2O溶于少量水中,再用水稀释至100 mL |
| C、将20 mL 5.0 mol?L-1 Na2SO4溶液用水稀释至100 mL |
| D、将50 mL 2.0 mol?L-1 Na2SO4溶液注入100 mL容量瓶中再加水至100 mL |
下列图示实验合理的是( )
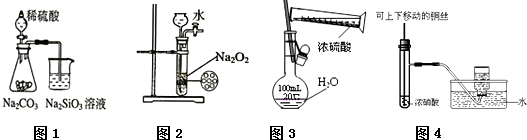

| A、图1为证明非金属性强弱:S>C>Si |
| B、图2为制备少量氧气 |
| C、图3为配制一定物质的量浓度的硫酸溶液 |
| D、图4为制备并收集少量NO2气体 |
把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为( )
| A、c (CH3COO-)<c (Na+) |
| B、c (CH3COOH)+c (CH3COO-)=0.01mol/L |
| C、c (CH3COOH)>c (CH3COO-) |
| D、c (OH-)>c (H+) |
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: