题目内容
铝粉和氧化铁粉末的混合物制成的铝热剂可用于焊接钢轨.现取不同质量的该铝热剂分别和100mL同浓度的NaOH溶液反应,所取铝热剂的质量与产生气体的体积关系如下表(气体体积均在标准状况下测定).
计算:
(1)该铝热剂中铝的质量分数;
(2)NaOH溶液物质的量浓度;
(3)15g该铝热剂发生铝热反应(2Al+Fe2O3
2Fe+Al2O3)理论上产生铁的质量.
| ① | ② | ③ | |
| 铝热剂质量/g | 7.5 | 15.0 | 20.0 |
| 气体体积/L | 3.36 | 6.72 | 6.72 |
(1)该铝热剂中铝的质量分数;
(2)NaOH溶液物质的量浓度;
(3)15g该铝热剂发生铝热反应(2Al+Fe2O3
| ||
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:(1)①②组金属Al完全反应,由第①足数据计算,根据方程式计算Al的质量,在利用质量分数定义计算;
(2)根据反应的方程式计算反应中消耗NaOH的物质的量,进而计算物质的量浓度;
(3)计算15g铝热剂中Al的质量,氧化铁的质量,进行过量计算,根据不足量的物质算生成Fe的质量;
(2)根据反应的方程式计算反应中消耗NaOH的物质的量,进而计算物质的量浓度;
(3)计算15g铝热剂中Al的质量,氧化铁的质量,进行过量计算,根据不足量的物质算生成Fe的质量;
解答:
解:(1)加入铝热剂7.5g时,固体完全反应,此时n(H2)=
=0.15mol,
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
n(Al) 0.15mol
n(Al)=0.1mol,m(Al)=0.1mol×27g/mol=2.7g
Al%=
=36%.
答:该铝热剂中铝的质量分数为36%;
(2)生成氢气6.72L时,气体的体积不再变化,说明NaOH完全反应,根据方程式计算.
n(H2)=
=0.3mol,
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 2mol 3mol
n(NaOH) 0.3mol
n(NaOH)=0.2mol,c(NaOH)=
=
=2mol/L,
答:NaOH溶液物质的量浓度为2mol/L;
(3)15g铝热剂中:m(Al)=15×36%=5.4g,即 n(Al)=
=0.2mol,
m(Fe2O3)=15-5.4=9.6g,即n(Fe2O3)=
=0.06mol,
由方程式2Al+Fe2O3
2Fe+Al2O3可知,0.06molFe2O3完全反应需要0.12molAl,故Al过量,Fe2O3完全反应,由铁元素守恒可知n(Fe)=2n(Fe2O3)=0.12mol,故m(Fe)=0.12mol×56g/mol=6.72g,
答:理论上产生铁的质量为6.72g;
| 3.36L |
| 22.4L/mol |
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
n(Al) 0.15mol
n(Al)=0.1mol,m(Al)=0.1mol×27g/mol=2.7g
Al%=
| 2.7g |
| 7.5g |
答:该铝热剂中铝的质量分数为36%;
(2)生成氢气6.72L时,气体的体积不再变化,说明NaOH完全反应,根据方程式计算.
n(H2)=
| 6.72L |
| 22.4L/mol |
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 2mol 3mol
n(NaOH) 0.3mol
n(NaOH)=0.2mol,c(NaOH)=
| n |
| v |
| 0.2mol |
| 0.1L |
答:NaOH溶液物质的量浓度为2mol/L;
(3)15g铝热剂中:m(Al)=15×36%=5.4g,即 n(Al)=
| 5.4g |
| 27g/mol |
m(Fe2O3)=15-5.4=9.6g,即n(Fe2O3)=
| 9.6g |
| 160g/mol |
由方程式2Al+Fe2O3
| ||
答:理论上产生铁的质量为6.72g;
点评:本题考查混合物的有关计算,难度中等,关键是根据固体质量与气体关系确定完全反应的物质,(3)中注意需要进行过量计算.

练习册系列答案
相关题目
可用Zn+Br2═ZnBr2 设计成蓄电池,其中正极反应是( )
| A、Zn→Zn2++2e- |
| B、Br2+2e-→2Br- |
| C、2Br-→Br2+2e- |
| D、Zn2++2e-→Zn |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
| A、增大CO的浓度 | B、降低温度 |
| C、升高温度 | D、增大压强 |
近几年流行喝苹果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为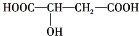 ,下列说法不正确的是( )
,下列说法不正确的是( )
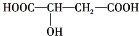 ,下列说法不正确的是( )
,下列说法不正确的是( )| A、苹果酸在一定条件下能发生酯化反应 |
| B、苹果酸在一定条件下能发生催化氧化反应 |
| C、1 mol苹果酸能与2 mol的Na发生反应 |
| D、1 mol苹果酸与Na2CO3溶液反应最多消耗3 mol Na2CO3 |
下列有关金属及其合金的说法正确的是( )
| A、地壳中含量最多的金属元素是铁 |
| B、合金与各组分金属相比一般具有更低的熔点 |
| C、生铁、普通钢和不锈钢中的碳含量依次增加 |
| D、在化学反应中金属失电子,被还原 |
下列各组单质中,前者在一定的条件下能将后者从其化合物中置换出来的是( )
①Al、Fe ②Cl2、S ③Mg、C ④H2、Cu ⑤C、Si ⑥Fe H2.
①Al、Fe ②Cl2、S ③Mg、C ④H2、Cu ⑤C、Si ⑥Fe H2.
| A、只有①③⑥ |
| B、只有②④⑥ |
| C、只有①②③④⑥ |
| D、①②③④⑤⑥ |
在指定条件下,下列各组离子有可能大量共存的是( )
| A、滴入KSCN溶液显红色的溶液中:K+、Na+、SO42-、AlO2- |
| B、水电离出的c(H+)=1.0×10-13mol?L-1的溶液中:K+、Fe2+、I-、NO3- |
| C、pH=13的溶液中:Na+、K+、SiO32-、SO42- |
| D、加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、CO32- |