题目内容
6.下列目的能达到的是( )| A. | 将58.5 g NaCl溶于1 L水中,可得1 mol/L的NaCl溶液 | |
| B. | 可使用250 mL容量瓶分两次完成490 mL某浓度的BaCl2溶液的配制 | |
| C. | 将25.0 g胆矾溶于水后配成100 mL溶液所得溶液浓度为1 mol/L | |
| D. | 将78 g Na2O2溶于水配成1 L溶液,可得到浓度为1 mol/L的溶液 |
分析 A.氯化钠溶于1L水中,所得溶液体积不是1L;
B.配制490mL溶于,必须选用规格为500mL的容量瓶;
C.根据n=$\frac{m}{M}$计算出胆矾的物质的量,然后根据c=$\frac{n}{V}$计算出所得溶液浓度;
D.78g过氧化钠的物质的量为1mol,溶于水生成2mol氢氧化钠,所得溶液浓度为2mol/L.
解答 解:A.将58.5 g NaCl溶于1 L水中,所得溶液体积不是1L,所得溶液浓度不是1mol/L,故A错误;
B.配制490 mL某浓度的BaCl2溶液,应该选用500mL容量瓶配制,不能分两次配制,故B错误;
C.25.0 g胆矾的物质的量为:$\frac{25.0g}{250g/mol}$=0.1mol,所得溶液的浓度为:c=$\frac{0.1mol}{0.1L}$=1mol/L,故C正确;
D.78 g Na2O2的物质的量为:$\frac{78g}{78g/mol}$=1mol,1mol过氧化钠与水反应生成2molNaOH,则所得溶液浓度为:$\frac{2mol}{1L}$=2mol/L,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度不大,侧重考查物质的量浓度的概念及表达式,明确配制一定物质的量浓度的溶液方法为解答关键,试题有利于提高学生的分析能力及化学计算能力.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
14.下列烷烃分子中的一个氢原子被一个氯原子取代后,只能生成三种沸点不同的产物的是( )
| A. | CH3CH2CH3 | B. | CH3CH3 | C. | CH3CH2CH2CH2CH3 | D. | CH3CH2CH2CH3 |
1.在食品加工或餐饮业中使用量特别要注意严加控制的物质是( )
| A. | 氯化钠 | B. | 谷氨酸钠(鸡精) | C. | 碳酸氢铵 | D. | 亚硝酸钠 |
18.碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛.完成下列填空:
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜.写出该反应的化学方程式4KI+2CuSO4=I2+Cu2I2↓+2K2SO4.
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去.写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是H2SO3、KI、Cu2I2.
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:2Cu2I2+Hg═Cu2HgI4(玫瑰红)+2Cu,产物Cu2HgI4中Cu元素显+1价.当有1molCu2I2参与反应时,转移电子1mol.
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再通入适量的Cl2后进行N操作.试剂M和操作N的组合正确的是bd(选填编号)
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜.写出该反应的化学方程式4KI+2CuSO4=I2+Cu2I2↓+2K2SO4.
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去.写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是H2SO3、KI、Cu2I2.
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:2Cu2I2+Hg═Cu2HgI4(玫瑰红)+2Cu,产物Cu2HgI4中Cu元素显+1价.当有1molCu2I2参与反应时,转移电子1mol.
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再通入适量的Cl2后进行N操作.试剂M和操作N的组合正确的是bd(选填编号)
| 选项 | 试剂M | 操作N |
| a | 碘化钾溶液 | 升华 |
| b | 氢碘酸溶液 | 萃取分液 |
| c | 氢气 | 过滤 |
| d | 氢硫酸溶液 | 过滤 |
16.下列有关化学用语表示正确的是( )
| A. | 水分子的比例模型: | B. | F-的结构示意图: | ||
| C. | CO2的结构式:O-C-O | D. | 中子数为8的碳原子: |
 根据下列图示变化及已知条件填空.
根据下列图示变化及已知条件填空. .元素Z在周期表中的位置是第三周期IVA族
.元素Z在周期表中的位置是第三周期IVA族 .乙烯与溴水的反应是加成反应.把甲烷和氯气混合在一起的试管倒置在装有饱和食盐水的水槽中进行光照有几种产物5种,最多的是氯化氢.
.乙烯与溴水的反应是加成反应.把甲烷和氯气混合在一起的试管倒置在装有饱和食盐水的水槽中进行光照有几种产物5种,最多的是氯化氢.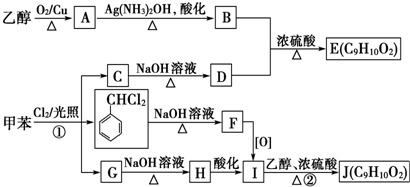
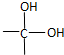 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$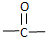
 ;J的结构简式为
;J的结构简式为 .
. .
.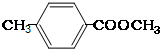 、
、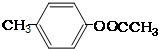 .
.