题目内容
1.下列说法中错误的是( )| A. | 元素电负性越大的原子,吸引电子的能力越强 | |
| B. | 在NH4+ 和[Cu(NH3)4]2+中都存在配位键 | |
| C. | SO2、SO3都是极性分子 | |
| D. | NF3较NH3难于与Cu2+形成配位键 |
分析 A.元素电负性是表示对键合电子的吸引力的大小;
B.NH4+中N原子与H+形成配位键,[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键;
C.SO2是极性分子,SO3分子是非极性分子;
D.F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤电子对的吸引能力增强,难以形成配位键.
解答 解:A.非金属性越强,电负性越大,该元素的原子吸引电子的能力越强,故A正确;
B.NH4+中N原子与H+形成配位键,[Cu(NH3)4]2+中Cu2+与NH3之间形成配位键,所以在NH4+ 和[Cu(NH3)4]2+中都存在配位键,故B正确;
C.SO2是极性分子,SO3分子是非极性分子,所以二者分子的极性不同,故C错误;
D.F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤电子对的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子,故D正确;
故选C.
点评 本题考查了分子极性的判断、配位键、电负性,题目考查知识点较多,但是较基础,难度不大,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
12.实验室里用下列仪器和药品制取纯净的无水氯化铜.根据要求完成以下问题:
(1)按气体从左向右流动,装置②在④左边,则②中加入的液体是饱和食盐水;
(2)装置⑤中发生反应的化学方程式是MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2Cl2↑+2H2O;
(3)实验开始时,应先点燃⑤(填装置序号)处的酒精灯,否则CuCl2中含有CuO(填化学式)杂质.待充分反应后,装置①的玻璃管中剩余物呈棕黄色;
(4)某实验小组组装装置时,在①和⑥之间添加了一个盛有浓硫酸的洗气瓶,其作用是防止氢氧化钠溶液中的水蒸气进入装置①.
| 序号 | ① | ② | ③ | ④ | ③ | ⑥ |
| 仪器及装置图 |  |  |  |  |  |  |
(2)装置⑤中发生反应的化学方程式是MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2Cl2↑+2H2O;
(3)实验开始时,应先点燃⑤(填装置序号)处的酒精灯,否则CuCl2中含有CuO(填化学式)杂质.待充分反应后,装置①的玻璃管中剩余物呈棕黄色;
(4)某实验小组组装装置时,在①和⑥之间添加了一个盛有浓硫酸的洗气瓶,其作用是防止氢氧化钠溶液中的水蒸气进入装置①.
9.下列反应的离子方程式书写正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 稀硫酸与Ba(OH)2溶液混合:SO42-+Ba2+═BaSO4↓ | |
| C. | 稀硝酸滴在大理石上:CaCO3+2H+═Ca2++H2CO3 | |
| D. | 氧化铁与稀盐酸混合:Fe2O3+6H+═2Fe3++3H2O |
16.某混合溶液中溶质所含离子的物质的量浓度如表,则下列有关说法不正确的是( )
| 溶质所含离子 | SO42- | M | Mg2+ | Fe2+ |
| 物质的量浓度 | c | 3 | 3 | 2 |
| A. | 若M是NO3-,则c为3.5 | |
| B. | 若使Fe2+浓度降低,可以加入试剂NaOH | |
| C. | 若M是NH4+,则配制溶液所用的溶质不一定是3种 | |
| D. | 若加入BaCl2溶液能产生两种沉淀,则M可能是CO32- |
6.“纳米材料”是指直径在几纳米到几十纳米的材料.如将“纳米材料”分散到液体分散剂中,所得混合物具有的性质是( )
| A. | 能全部透过半透膜 | B. | 所得物质一定为悬浊液或乳浊液 | ||
| C. | 所得混合物一定能导电 | D. | 有丁达尔效应 |
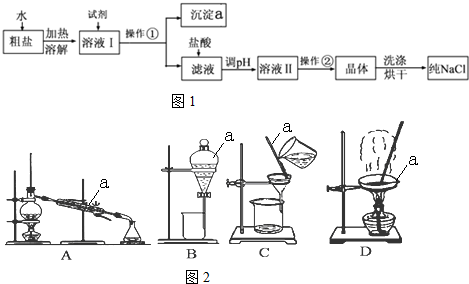
19.关于粗盐提纯下列说法中正确的是( )
| A. | 溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解 | |
| B. | 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 | |
| C. | 将制得的晶体转移到新制过滤器中用大量水进行洗涤 | |
| D. | 当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干 |