题目内容
将13.4g KBr和KCl的混合物溶于水,配成500mL溶液,通入过量Cl2,反应后将溶液蒸干得11.18g固体,所配溶液中K+、Cl-、Br-的物质的量浓度之比为( )
| A、1:1:1 |
| B、1:2:3 |
| C、1:3:2 |
| D、3:2:1 |
考点:物质的量浓度的相关计算,化学方程式的有关计算
专题:计算题
分析:考虑到溶液为电中性,阳离子所带正电荷的总量等于阴离子所带负电荷的总量可得出n(K+)=n(Cl-)+n(Br-),以此来解答较为简单.
解答:
解:A.1≠1+1,说明n(K+)≠n(Cl-)+n(Br-),故A错误;
B.1≠2+3,说明n(K+)≠n(Cl-)+n(Br-),故B错误;
C.1≠3+2,说明n(K+)≠n(Cl-)+n(Br-),故C错误;
D.3=2+1,说明n(K+)=n(Cl-)+n(Br-),故D正确.
故选D.
B.1≠2+3,说明n(K+)≠n(Cl-)+n(Br-),故B错误;
C.1≠3+2,说明n(K+)≠n(Cl-)+n(Br-),故C错误;
D.3=2+1,说明n(K+)=n(Cl-)+n(Br-),故D正确.
故选D.
点评:题目按常规方法或差量法都可解,但都费事费力,从溶液电中性角度解答,运用守恒原理解答常常起到意想不到的效果,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、电解NaOH溶液时,溶液浓度将减小,pH增大 |
| B、电解H2SO4溶液时,溶液浓度将增大,pH减小 |
| C、电解Na2SO4溶液时,溶液浓度将增大,pH变大 |
| D、电解NaCl溶液时,溶液浓度将减小,pH不变 |
将pH=12的氨水与pH=2的盐酸等体积混合后,则正确的是( )
| A、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| C、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
下列叙述中正确的是( )
| A、构成原电池正极和负极的材料必须是两种金属 |
| B、由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极 |
| C、马口铁(镀锡铁)破损时与电解质溶液接触,锡先被腐蚀 |
| D、镁.铝作电极,与硫酸构成原电池,电流由铝经导线流向镁 |
物质的量浓度相同的三种一元酸的钠盐NaX、NaY、NaZ溶液的pH分别为7、8、9,则同物质的量浓度的这三种一元酸的酸性由强到弱的顺序是( )
| A、HX、HY、HZ |
| B、HZ、HY、HX |
| C、HX、HZ、HY |
| D、HY、HX、HZ |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- |
| B、含有0.1mol?L-1 Fe3+的溶液中:K+、Mg2+、I-、SO42- |
| C、能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- |
| D、c(Al3+)=0.5mol?L-1的溶液中:Na+、K+、[Al(OH)4]-、SO42- |
下列反应中,盐酸作为氧化剂的是( )
| A、Zn+2HCl═ZnCl2+H2↑ | ||||
| B、FeS+2HCl═FeCl2+H2S↑ | ||||
| C、NH3+HCl═NH4Cl | ||||
D、MnO2+4HCl
|
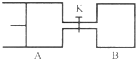 如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )
如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )| A、两容器中达到平衡的时间A<B |
| B、A容器中X的转化率为25%,且比B容器中X的转化率小 |
| C、打开K一段时间达到平衡时,A的体积为0.8aL(连通管中气体体积不计) |
| D、打开K达到新平衡后,升高B容器温度,A容器体积一定减小 |