题目内容
 下列装置可实现电解CuCl2溶液,c、d均为石墨.读图回答下列问题:
下列装置可实现电解CuCl2溶液,c、d均为石墨.读图回答下列问题:(1)Ⅰ是
(2)写出下列电极方程式Fe:
(3)当Cu增重3.2g 时,Ⅱ中收集到标准状况下气体体积为
(4)由原电池两个电极发生的反应可知:一个完整有氧化还原反应方程式可拆写成两个“半反应式”,一个是氧化反应式,一个是还原反应式,并由此实现了化学能与电能的相互转化;则3NO2+H2O═2H++2NO3-+NO反应的氧化反应式为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)I能自发的进行氧化还原反应,属于原电池,II为电解池;
(2)I中Fe易失电子作负极、Cu作正极,c为阳极、d为阴极,Fe电极上铁失电子发生氧化反应,c电极上铜离子放电;
(3)根据转移电子相等计算生成气体体积;
(4)失电子化合价升高的反应物发生氧化反应.
(2)I中Fe易失电子作负极、Cu作正极,c为阳极、d为阴极,Fe电极上铁失电子发生氧化反应,c电极上铜离子放电;
(3)根据转移电子相等计算生成气体体积;
(4)失电子化合价升高的反应物发生氧化反应.
解答:
解:(1)I能自发的进行氧化还原反应,属于原电池,Fe为负极、Cu为正极,II有外接电源,为电解池,故答案为:原电;电解;
(2)I中Fe易失电子作负极、Cu作正极,c为阳极、d为阴极,Fe电极上铁失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+,c电极上铜离子放电,电极反应式为Cu2++2e-=Cu,故答案为:Fe-2e-=Fe2+;Cu2++2e-=Cu;
(3)Cu增重3.2g时,转移电子的物质的量=
×2=0.1mol,根据转移电子相等得生成气体体积=
×22.4L/mol=1.12L,故答案为:1.12;
(4)失电子化合价升高的反应物发生氧化反应,则该反应的氧化反应为2NO2-2e-+H2O═2H++2NO3-,故答案为:2NO2-2e-+H2O═2H++2NO3-.
(2)I中Fe易失电子作负极、Cu作正极,c为阳极、d为阴极,Fe电极上铁失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+,c电极上铜离子放电,电极反应式为Cu2++2e-=Cu,故答案为:Fe-2e-=Fe2+;Cu2++2e-=Cu;
(3)Cu增重3.2g时,转移电子的物质的量=
| 3.2g |
| 64g/mol |
| 0.1mol |
| 2 |
(4)失电子化合价升高的反应物发生氧化反应,则该反应的氧化反应为2NO2-2e-+H2O═2H++2NO3-,故答案为:2NO2-2e-+H2O═2H++2NO3-.
点评:本题考查了原电池和电解池原理,知道原电池和电解池的判断方法、各个电极上发生的反应即可解答,会根据反应物、生成物书写半电池反应式,为易错点.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 |
| C、向水中加入少量固体CH3COONa,平衡正向移动,c(H+)降低 |
| D、将水加热,Kw增大,pH不变 |
下列说法正确的是( )
| A、甲苯的一氯代物有4种结构,甲苯与过量H2催化加成的最终产物,其一氯代物也有4种结构 |
| B、淀粉不能与银氨溶液发生反应,淀粉水解后的产物也不能与银氨溶液发生反应 |
| C、乙酸与乙醇反应生成乙酸乙酯属于取代反应,乙酸乙酯水解生成乙酸与乙醇也属于取代反应 |
| D、柴油、汽油属于烃类物质,牛油、植物油也属于烃类物质 |

 石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计如图实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:
石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计如图实验图以确认上述混合气体中有C2H4和SO2,回答下列问题: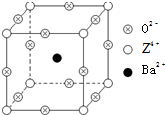 已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型常见气态氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如右图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型常见气态氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如右图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.