题目内容
25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 |
| C、向水中加入少量固体CH3COONa,平衡正向移动,c(H+)降低 |
| D、将水加热,Kw增大,pH不变 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:水的电离达到平衡:H2O?H++OH-,加入与H+或OH-反应的物质,改变c(OH-)或c(H+),可使平衡发生移动,KW只与温度有关.
解答:
解:A.向水中加入稀氨水溶液,平衡逆向移动,但c(OH-)升高,故A错误;
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW只与温度有关,温度不变,则KW不变,故B错误;
C.向水中加入少量固体CH3COONa,醋酸根离子会水解,使水的电离平衡正向移动,c(H+)减小,故C正确;
D.水的电离为吸热反应,加热促进电离,则KW增大,pH变小,故D错误.
故选C.
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW只与温度有关,温度不变,则KW不变,故B错误;
C.向水中加入少量固体CH3COONa,醋酸根离子会水解,使水的电离平衡正向移动,c(H+)减小,故C正确;
D.水的电离为吸热反应,加热促进电离,则KW增大,pH变小,故D错误.
故选C.
点评:本题考查弱电解质的电离,侧重于水的电离的考查,注意把握影响水的电离的因素以及水的离子积常数的特点.

练习册系列答案
相关题目
常温时,下列溶液的pH等于8或大于8的是( )
| A、NH4Cl溶液 |
| B、pH=6的醋酸用水稀释100倍 |
| C、pH=10的氢氧化钠溶液稀释1000倍 |
| D、0.1 mol?L-1的硫酸100 mL跟0.2 mol?L-1 NaOH溶液150 mL发生反应 |
下列说法不正确的是( )
| A、把硝酸亚铁溶液与稀盐酸混合,因不符合复分解反应进行到底的条件,所以它们不能发生化学反应 |
| B、分液实验操作时,下层液体从下端放出,上层液体从上口倒出 |
| C、氢氧化钠固体应保存在带有橡胶塞的广口瓶里 |
| D、凡是有元素化合价升降的化学反应都是氧化还原反应 |
一定条件下,某反应的化学方程式为:CO2+NO?NO2+CO,下列说法正确的是( )
| A、升高温度,正反应速率增大,逆反应速率减少 | ||
| B、恒温时,压缩容器的体积,颜色加深,因平衡左移 | ||
C、达到平衡,其平衡常数为K=
| ||
| D、恒容时,升高温度,混合气体的颜色加深,该反应的焓变为正值 |
根据甘油(丙三醇)的结构,它不可能发生的反应是( )
| A、消去反应 | B、取代反应 |
| C、氧化反应 | D、加成反应 |
据最新报道,放射性同位素钬
Ho可有效地治疗肝癌.该同位素原子的质量数与核电荷数之差为( )
166 67 |
| A、32 | B、67 | C、99 | D、166 |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、标况下,22.4 L水中含有NA个H2O分子 |
| B、14 g N2含有的核外电子总数为NA |
| C、1 mol乙烯中含2 NA个碳碳双键 |
| D、2.3 g金属钠与足量水反应时失去的电子数是0.1NA |
下列实验中①配制一定物质的量浓度的溶液;②pH试纸的使用;③过滤;④蒸发,都要用到的仪器是( )
| A、玻璃棒 | B、烧杯 |
| C、蒸发皿 | D、酒精灯 |
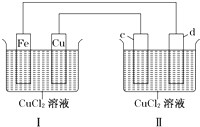 下列装置可实现电解CuCl2溶液,c、d均为石墨.读图回答下列问题:
下列装置可实现电解CuCl2溶液,c、d均为石墨.读图回答下列问题: