题目内容
20.现有部分短周期元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
 ,元素Y在周期表中的位置是第二周期VA族.
,元素Y在周期表中的位置是第二周期VA族.(2)元素Y与氢元素形成一种离子YH4+,则检测溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+离子,反之,不存在NH4+离子.
(3)元素X与元素Y相比,非金属性较强的是N (用元素符号表示),下列表述能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物对应的水化物的酸性比X的最高价氧化物对应的水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态.
分析 X、Y、Z三种短周期元素,X元素原子最外电子数是次外层电子数的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Y元素常温下单质为双原子分子,其氢化物的水溶液呈碱性,则Y为氮元素;Z为第三周期元素的简单离子中半径最小,则Z为Al元素,以此解答该题.
解答 解:X、Y、Z三种短周期元素,X元素原子最外电子数是次外层电子数的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Y元素常温下单质为双原子分子,其氢化物的水溶液呈碱性,则Y为氮元素;Z为第三周期元素的简单离子中半径最小,则Z为Al元素,
(1)碳元素的一种同位素可测定文物年代,这种同位素的符号是614C,铝离子的结构示意图为 ,Y为氮元素,位于周期表第二周期VA族,
,Y为氮元素,位于周期表第二周期VA族,
故答案为:614C; ;第二周期VA族;
;第二周期VA族;
(2)元素Y的与氢元素形成一种离子YH4+为NH4+,检验溶液中存在NH4+离子的方法是向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+离子,反之,不存在NH4+离子,
故答案为:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+离子,反之,不存在NH4+离子;
(3)根据元素周期律可知,氮的非金属性强于碳,a.元素非金属性与状态无关,故不能证明氮的非金属性强于碳;
b.元素的非金属性越强,对应的最高价氧化物水化物的酸性越强,所以氮的最高价氧化物水化物的酸性比碳的最高价氧化物水化物的酸性强,能证明氮的非金属性强于碳;
c.碳与氮形成的化合物中碳元素呈正价态,说明氮原子得电子能力大于碳原子,所以能证明氮的非金属性强于碳,故选bc,
故答案为:N;bc.
点评 本题考查了位置结构与性质的关系,题目难度中等,试题侧重于学生的分析能力的考查,正确推断各元素名称为解答关键,注意把握原子的结构特点.

 名校课堂系列答案
名校课堂系列答案| A. |  | B. |  | C. | (CH3CO)2O | D. |  |
| A. | NaHCO3溶液 | B. | 新制Cu(OH)2悬浊液 | C. | 石蕊试液 | D. | 溴水 |
| A. | H2S+2HNO3═S↓+2NO2↑十2H2O | B. | CuO+2HNO3═Cu (NO3)2十H2O | ||
| C. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑十O2↑十2H2O | D. | 3Cu+8HNO3═3Cu (NO3) 2+2NO↑十4H2O |


 己知1mol NO2和1mol CO反应生成CO2和NO过程中能量变化如图所示.请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
己知1mol NO2和1mol CO反应生成CO2和NO过程中能量变化如图所示.请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.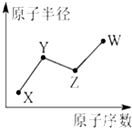 U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随
U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随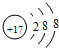 ;
; ;
;