题目内容
设NA为阿伏加德罗常数,下列叙述不正确的是( )
| A、工业可采用火法炼铜:Cu2S+O2═2Cu+SO2 每生成2mol铜,反应共转移6NA个电子 | ||
| B、P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则1mol该分子中含有的共价键数目是12NA | ||
| C、一定条件下定容容器中充入3molH2(g)和1mol N2(g)发生反应:3H2(g)+N2(g)?2NH3(g);△H=-QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25NA | ||
D、标准状况下,定容容器中盛有某气体纯净物,气体密度为ρg?L-1,则该物质相对分子质量为:
|
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.该反应中Cu元素化合价由0价变为+1价,O元素化合价由0价变为-2价、S元素化合价由-2价变为+4价,根据化合价变化计算转移电子数;
B.P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则每个P4O6分子中12个共价键,据此计算1mol该分子中共价键个数;
C.设:当该反应放出0.25QkJ的热量时,参加反应的氢气的物质的量为x,
3H2(g)+N2(g)?2NH3(g)△H=-QkJ/mol
3mol QkJ
x 0.25QkJ
3mol:QkJ=x:0.25kJ
x=
=
mol,
没有参加反应的氢气量就是平衡时存在的氢气量;
D.根据ρ=
计算其摩尔质量,摩尔质量在数值上等于其相对分子质量.
B.P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则每个P4O6分子中12个共价键,据此计算1mol该分子中共价键个数;
C.设:当该反应放出0.25QkJ的热量时,参加反应的氢气的物质的量为x,
3H2(g)+N2(g)?2NH3(g)△H=-QkJ/mol
3mol QkJ
x 0.25QkJ
3mol:QkJ=x:0.25kJ
x=
| 3mol×0.25QkJ |
| QkJ |
| 3 |
| 4 |
没有参加反应的氢气量就是平衡时存在的氢气量;
D.根据ρ=
| M |
| Vm |
解答:
解:A.该反应中Cu元素化合价由0价变为+1价,O元素化合价由0价变为-2价、S元素化合价由-2价变为+4价,每生成2mol铜,有1molCu2S参加反应,反应共转移电子数=1mol×(4+2)×NA/mol=6NA,故A正确;
B.P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则每个P4O6分子中12个共价键,所以1mol该分子中共价键个数为12NA,故B正确;
C.设:当该反应放出0.25QkJ的热量时,参加反应的氢气的物质的量为x,
3H2(g)+N2(g)?2NH3(g)△H=-QkJ/mol
3mol QkJ
x 0.25QkJ
3mol:QkJ=x:0.25kJ
x=
=
mol,
没有参加反应的氢气的物质的量=3mol-0.75mol=2.25mol,则氢气分子个数为2.25NA,故C正确;
D.根据ρ=
知其摩尔质量=22.4ρ,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量为22.4ρ,故D错误;
故选D.
B.P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则每个P4O6分子中12个共价键,所以1mol该分子中共价键个数为12NA,故B正确;
C.设:当该反应放出0.25QkJ的热量时,参加反应的氢气的物质的量为x,
3H2(g)+N2(g)?2NH3(g)△H=-QkJ/mol
3mol QkJ
x 0.25QkJ
3mol:QkJ=x:0.25kJ
x=
| 3mol×0.25QkJ |
| QkJ |
| 3 |
| 4 |
没有参加反应的氢气的物质的量=3mol-0.75mol=2.25mol,则氢气分子个数为2.25NA,故C正确;
D.根据ρ=
| M |
| Vm |
故选D.
点评:本题考查阿伏伽德罗常数的计算,侧重考查化学平衡计算、氧化还原反应、物质结构等知识点,注意B中该分子结构为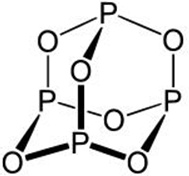 ,注意A中氧化剂有两种,为易错点.
,注意A中氧化剂有两种,为易错点.
 ,注意A中氧化剂有两种,为易错点.
,注意A中氧化剂有两种,为易错点.
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
取一质量为mg的铜丝在空气中加热后,插入下列液体中,铜丝的质量仍为mg的是( )
| A、盐酸 |
| B、NaOH溶液 |
| C、CH3CHO |
| D、CH3OH |
若N0代表阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下11.2LN2含有的分子数为0.5N0 |
| B、9mL水和标准状况下11.2L氮气含有相同的分子数(注水的密度为1g/mL) |
| C、同温同压下,N0个NO与N0个N2和02的混合气体的体积相等 |
| D、25℃、1.01×105Pa时,11.2L氧气所含的原子数目为N0 |
有M、N两溶液,各含有下列十四种离子中的七种离子:Al3+、Cl-、Na+、K+、NO3-、OH-、SO32-、MnO4-、Fe3+、NH4+、H+、SO42-、CO32-、AlO2-.已知两溶液所含离子各不相同,每组溶液中的阳离子至少有2种,则下列说法正确的是( )
| A、如果M溶液呈强酸性,则N溶液中可能含有的阴离子有:OH-、NO3-、CO32- |
| B、如果M溶液呈强碱性,则N溶液中可能含有的阴离子有:MnO4-、AlO2-、SO42- |
| C、如果M溶液具有强还原性,则N溶液中可能含有的阴离子有:MnO4-、NO3-、SO42- |
| D、如果M溶液具有强氧化性,则N溶液中可能含有的阳离子有:K+、Na+、NH4+ |
0.5L的Fe2(SO4)3溶液中Fe3+的浓度为0.2mol/L,与0.2L0.5mol/L的Na2SO4溶液中SO42-的浓度之比是( )
| A、3:2 | B、2:5 |
| C、3:5 | D、5:3 |
铜粉放入稀H2SO4中,加热后无明显现象,当加入一种盐后,铜粉质量减小,溶液变蓝,同时有气体逸出,此盐可能是( )
| A、FeSO4 |
| B、Na2CO3 |
| C、KNO3 |
| D、KCl |