题目内容
14.某碱式碳酸镁[Mg(OH)3•xMgCO3]固体31g恰好与100ml 8mol•L-1的盐酸反应生成氯化镁溶液,则x的值为( )| A. | 3 | B. | 4 | C. | 2 | D. | 1 |
分析 恰好与100ml 8mol•L-1的盐酸反应生成氯化镁溶液,则2n(Mg)=n(HCl),结合n=$\frac{m}{M}$=cV计算x值.
解答 解:恰好与100ml 8mol•L-1的盐酸反应生成氯化镁溶液,则2n(Mg)=n(HCl)=0.1L×8mol/L=0.8mol,
n[Mg(OH)2•xMgCO3]=$\frac{31g}{(58+84x)g/mol}$,
则n(Mg)=$\frac{31g}{(58+84x)g/mol}$×(1+x)=0.4mol,
解得:x=3,
故选A.
点评 本题考查化学反应方程式的计算,为高频考点,把握氯化镁的构成及Mg与Cl的原子个数关系为解答的关键,注意守恒法应用,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料 | |
| B. | 绿色化学的核心是对环境产生的污染进行治理 | |
| C. | 氯化铵、二氧化硫溶于水都能导电,所以它们都属于电解质 | |
| D. | 云、烟、雾等均能产生丁达尔现象 |
5.已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH?ΧΗ3COO-+H+△H1>0 (K1=1.75×10-5)
CH3COO-+H2O?ΧΗ3COOH+OH-△H2>0 ( K2=5.71×10-10 )
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
CH3COOH?ΧΗ3COO-+H+△H1>0 (K1=1.75×10-5)
CH3COO-+H2O?ΧΗ3COOH+OH-△H2>0 ( K2=5.71×10-10 )
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
| A. | 混合溶液pH>7 | |
| B. | 对混合溶液进行微热,K1增大、K2减小 | |
| C. | 调节混合溶液的pH至中性,则此时溶液中c(Na+)=c(CH3COO-) | |
| D. | 温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小 |
9.下列说法不正确的是( )
| A. | 化学反应中一定伴随能量变化 | |
| B. | 甲烷燃烧是将全部的化学能转化为热能 | |
| C. | 物质所含化学键键能越大,其越稳定 | |
| D. | 大量燃烧煤炭等化石燃料是造成雾霾天气的重要原因 |
19.有关下列流程的判断正确的是( )
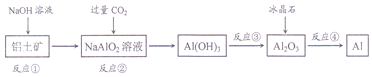

| A. | 流程中涉及的反应均为非氧化还原反应 | |
| B. | 反应②产生的阴离子主要为CO32- | |
| C. | 反应③在实验室中应在蒸发皿中进行 | |
| D. | 反应④的条件是对熔融状态下的反应物进行电解 |
6.下列有关化学用语表示正确的是( )
| A. | CO2的电子式: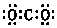 | B. | 中子数为21的钾原子:${\;}_{19}^{40}$K | ||
| C. | 甲烷分子的球棍模型: | D. | 氯离子的结构示意图: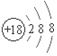 |
3.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层比内层多3个电子,Y、W同主族且W的质子数是Y的两倍,Z在短周期元素中金属性最强.下列说法正确的是( )
| A. | X的简单气态氢化物的热稳定性比Y的强 | |
| B. | W的氧化物的水化物的酸性一定比X的强 | |
| C. | 半径r(W)>r(Z)>r(Y)>r(X) | |
| D. | Z与Y形成的两种常见化合物中,阴、阳离子个数比均为1:2 |