题目内容
5.已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数CH3COOH?ΧΗ3COO-+H+△H1>0 (K1=1.75×10-5)
CH3COO-+H2O?ΧΗ3COOH+OH-△H2>0 ( K2=5.71×10-10 )
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
| A. | 混合溶液pH>7 | |
| B. | 对混合溶液进行微热,K1增大、K2减小 | |
| C. | 调节混合溶液的pH至中性,则此时溶液中c(Na+)=c(CH3COO-) | |
| D. | 温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小 |
分析 A.根据题干知,醋酸电离程度大于醋酸根离子水解程度,所以常温下,等体积、等物质的量浓度的醋酸和醋酸钠溶液混合呈酸性;
B.弱电解质的电离和盐类水解都是吸热反应,升高温度促进醋酸电离、醋酸根离子水解;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.温度不变,在混合溶液中加入少量NaOH固体,OH-和H+反应促进醋酸电离.
解答 解:A.根据题干知,醋酸电离程度大于醋酸根离子水解程度,所以常温下,等体积、等物质的量浓度的醋酸和醋酸钠溶液混合后,溶液中存在c(OH-)<c(H+),呈酸性,所以混合溶液pH<7,故A错误;
B.醋酸电离和醋酸根离子水解都是吸热反应,升高温度促进醋酸电离、醋酸根离子水解,所以对混合溶液进行微热,K1增大、K2增大,故B错误;
C.溶液呈中性,则c(OH-)=c(H+),任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)═c(CH3COO-),故C正确;
D.温度不变,在混合溶液中加入少量NaOH固体,OH-和H+反应促进醋酸电离,则溶液中c(CH3COO-)增大,故D错误;
故选C.
点评 本题考查弱电解质电离,明确醋酸电离和醋酸根离子水解程度相对大小与溶液酸碱性关系是解本题关键,知道任何电解质溶液中都存在电荷守恒和物料守恒,题目难度中等.

练习册系列答案
相关题目
13.化学学习要掌握正确的方法,分类法是其中的重要方法之-.下列有关物质的分类正确的是( )
| 酸 | 碱 | 盐 | 混合物 | |
| A | H2SO3 | 纯碱 | 明矾 | 盐酸 |
| B | HClO4 | 熟石灰 | 石灰石 | 液氯 |
| C | HI | 烧碱 | 小苏打 | 氯水 |
| D | NaHSO4 | 一水合氨 | 食盐 | 漂白粉 |
| A. | A | B. | B | C. | C | D. | D |
14.常温下,下列各组离子一定可以大量共存的是( )
| A. | 含ClO-的溶液中:H+、K+、Br-、I- | |
| B. | pH=1的溶液中:NH4+、Ba2+、CO32-、NO3- | |
| C. | 在与Al反应能放出H2的溶液中:Mg2+、HCO3-、SO42-、Cl- | |
| D. | 在pH=10的溶液中:Na+、K+、CH3COO-、NO3- |
13.乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计以下两套装置用乙醇、乙酸和浓硫酸分别制备乙酸乙酯(沸点77.2℃).下列说法不正确的是( )

| A. | 浓硫酸能加快酯化反应速率 | B. | 不断蒸出酯,会降低其产率 | ||
| C. | 装置b比装置a原料损失的少 | D. | 可用分液的方法分离出乙酸乙酯 |
20.下列过程中△H小于零的是( )
| A. | Ba(OH)2与NH4Cl固体混合 | B. | 氯化铵分解得氨气 | ||
| C. | 碳酸钙分解得二氧化碳 | D. | 实验室制备氢气 |
10.某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:
(1)①可以判断该分解反应已经达到化学平衡的是BC.
A.2v(NH3)=v(CO2)B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8(mol•L-1)3.
③氨基甲酸铵分解反应的焓变△H>0,熵变△S>0(填>、<或=).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min).
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)=v(CO2)B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8(mol•L-1)3.
③氨基甲酸铵分解反应的焓变△H>0,熵变△S>0(填>、<或=).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.

计算25℃时,0~6min氨基甲酸铵水解反应的平均速率0.05mol/(L•min).
17.下列有关实验操作、现象及结论的叙述正确的是( )
| A. | 用钠可以检验某无水酒精中是否含有水 | |
| B. | 除去甲烷中混有的少量乙烯,可以将混合气体通过酸性KMnO4溶液 | |
| C. | 制取乙酸乙酯时,试剂加入的顺序是:先加入乙醇,后慢慢加入浓硫酸,最后加入乙酸 | |
| D. | 在蔗糖溶液中加入少量稀硫酸,水浴加热后,再加入少量新制的氢氧化铜悬浊液,加热至沸腾,没有砖红色沉淀生成,说明蔗糖没有水解 |
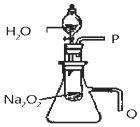 实验法是化学重要的研究物质性质的基本方法.某化学研究小组进行了如下实验,请回答问题.
实验法是化学重要的研究物质性质的基本方法.某化学研究小组进行了如下实验,请回答问题.