题目内容
 已知:4NH3+5O2
已知:4NH3+5O2 | 催化剂 |
| △ |
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80.
(1)a mol NO完全转化为HNO3理论上需要氧气
(2)为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为
(3)20.0mol NH3用空气氧化,产生混合物的组成为:NO 18.0mol、O2 12.0mol、N2 150.0mol和一定量硝酸,以及其他成分(高温下NO与O2不化合).计算氨转化为NO和HNO3的总转化率.
(4)20.0mol NH3和一定量空气充分反应后,再转化为硝酸.通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线.
考点:化学方程式的有关计算,氮的氧化物的性质及其对环境的影响
专题:计算题
分析:(1)根据一氧化氮和氧气完全转化为HNO3的关系式计算;
(2)使NH3恰好完全氧化为NO,根据氨气计算需要氧气的量,再根据体积分数公式进行计算;
(3)根据反应过程中氮气的量不变进行计算,算出生成硝酸的物质的量,再根据原子守恒计算转化率;
(4)采用极限法找出氨气、空气和硝酸的关系,并画出硝酸和空气的关系图象.
(2)使NH3恰好完全氧化为NO,根据氨气计算需要氧气的量,再根据体积分数公式进行计算;
(3)根据反应过程中氮气的量不变进行计算,算出生成硝酸的物质的量,再根据原子守恒计算转化率;
(4)采用极限法找出氨气、空气和硝酸的关系,并画出硝酸和空气的关系图象.
解答:
解:(1)设需要氧气的物质的量为x,
4NO+2H2O+3O2=4HNO3
4mol 3mol
amol x
x=
mol=0.75amol,则需要氧气的物质的量为0.75a mol,
故答案为:0.75a;
(2)根据氨气被氧气恰好完全氧化为NO的方程式,可假设氨气的体积是4L,设需要空气的体积为y,
4NH3+5O2
4NO+6H2O
4 5
4L 0.20y
y=
L=25L,氨-空气混合物中氨的体积分数=
≈0.14,
故答案为:0.14;
(3)设生成x mol HNO3,空气中氧气的体积分数为0.20,氮气的体积分数为0.80,空气中氮气的量是氧气的4倍,4(2x+18.0×
+12.0)=150.0,解得:x=1.5(mol),根据氮原子守恒,NH3的转化为HNO3的转化率=
×100%=7.5%; NH3的转化为NO的转化率=
×100%=97.5%,
故答案为:氨转化为NO和HNO3的转化率分别是7.5%和97.5%;
(4)4NH3+5O2
4NO+6H2O①,4NO+3O2 +2H2O=4HNO3②,将
得:NH3+2O2=H2O+HNO3③,由①③知,当
≤
,即
≤
时无硝酸生成,此时20.0mol氨气所需空气量为:
×20.0mol=125mol;
当
≤
≤
,即
≤
≤
,时有硝酸生成,此时20.0mol氨气所需空气量为10×20.0mol=200mol,生成硝酸的物质的量是20mol,所以HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线为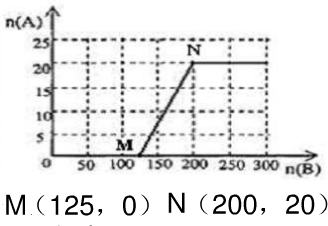 ,
,
答:HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线为 .
.
4NO+2H2O+3O2=4HNO3
4mol 3mol
amol x
x=
| 3a |
| 4 |
故答案为:0.75a;
(2)根据氨气被氧气恰好完全氧化为NO的方程式,可假设氨气的体积是4L,设需要空气的体积为y,
4NH3+5O2
| ||
| △ |
4 5
4L 0.20y
y=
| 4×5 |
| 4×0.20 |
| 4L |
| 4L+25L |
故答案为:0.14;
(3)设生成x mol HNO3,空气中氧气的体积分数为0.20,氮气的体积分数为0.80,空气中氮气的量是氧气的4倍,4(2x+18.0×
| 5 |
| 4 |
| 1.5mol |
| 20.0mol |
| 18.0+1.5 |
| 20 |
故答案为:氨转化为NO和HNO3的转化率分别是7.5%和97.5%;
(4)4NH3+5O2
| ||
| △ |
| ①+② |
| 2 |
| n(O2) |
| n(NH3) |
| 5 |
| 4 |
| n(空气) |
| n(NH3) |
| 25 |
| 4 |
| 5 |
| 4 |
当
| 5 |
| 4 |
| n(O2) |
| n(NH3) |
| 2 |
| 1 |
| 25 |
| 4 |
| n(空气) |
| n(NH3) |
| 10 |
| 1 |
 ,
,答:HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线为
 .
.
点评:本题考查了氧化还原反应的计算,难点是计算转化率,明确氮气和氧气的关系是解本题的关键,结合原子守恒来分析解答,题目难度较大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
相同质量的钠在下列情况下产生氢气最多的是( )
| A、放在足量水中 |
| B、放在足量盐酸中 |
| C、放在足量CuSO4溶液中 |
| D、用刺有小孔的铝,包好放入足量水底中(假设铝不参加反应) |
铊(元素符号Tl)是超导材料组成元素之一,位于第六周期,与元素Al同主族.以下对于铊(Tl)的性质推断错误的是( )
| A、Tl是易导电的银白色的金属 |
| B、Tl(OH)3是两性氢氧化物 |
| C、Tl的还原性强于Al |
| D、Tl能生成+3价的化合物 |
有KOH和Ca(OH)2的混合溶液.其中OH-的物质的量浓度为0.1mol/L,取此溶液500mL,向其中通入CO2,求最多消耗CO2的体积(V)为( )(单位为mL)
| A、1120 | B、2240 |
| C、560 | D、无法确定 |
500mL含有0.40mol碳酸钠的溶液和某浓度的400mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A、1.2mol/L |
| B、2 mol/L |
| C、0.2 mol/L |
| D、0.4mol/L |
下列有关物质应用的说法中不正确的是( )
| A、碳酸钠用于治疗胃溃疡病人的胃酸过多症 |
| B、Na2O2用作呼吸面具的供氧剂 |
| C、明矾用于净化生活用水 |
| D、Fe2O3用于制作红色染料 |
