题目内容
6.陕西省辉钼矿(主要成分为MoS2、Fe2O3、Al2O3、SiO2和CuFeS2)的含量在全国位居前列,用辉铝矿制取MoO3的工艺流程如图所示.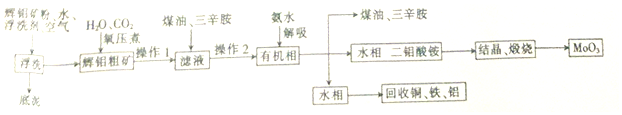
已知:三辛胺的化学式为N(C8H17)3.
(1)操作1的名称是 过滤.
(2)若在实验室中进行,则操作2用到的玻璃仪器有分液漏斗、烧杯.
(3)底泥的主要成分是SiO2(填化学式).
(4)氧压煮的过程中,MoS2发生的反应为2MoS2+9O2+6H2O=2H2MoO4+4H2SO4
①该反应中氧化剂与还原剂的物质的量之比为9:2.
②MoO3中Mo的化合价为+6,MoO3是酸性(填“酸性”或“碱性”)氧化物.
(5)高温煅烧二钼酸铵[(NH4)2Mo2O7]的化学方程式为(NH4)2Mo2O7$\frac{\underline{\;高温\;}}{\;}$2MoO3+2NH3↑+H2O.
(6)若用1×l04 kg辉钼矿(含0.16% MoS2)制取MoO3,该流程中钼元素的损耗率为10%,则最后得到MoO31.296×l03kg.
分析 辉铝矿粉(主要成分为MoS2、Fe2O3、Al2O3、SiO2和CuFeS2)加水、空气进行浮选得到辉钼粗矿,(4)氧压煮过程中,MoS2被氧化为可溶性弱酸H2MoO4,CuFeS2被氧化为CuSO4、Fe2(SO4)3,氧压煮过滤的滤液中含有H2MoO4、CuSO4、Fe2(SO4)3,滤液用煤油、三辛胺进行萃取,分液,将有机相用氨水解吸,有机相可循环,水相中含有Al3+、Fe3+、Cu2+,回收铜、铁、铝,将二钼酸铵溶液结晶、煅烧得到MoO3,据此分析解答.
解答 解:(1)经过操作1得到滤液,则该操作为过滤;
故答案为:过滤;
(2)经过操作2得到有机相,则该操作为分液,需要的玻璃仪器有分液漏斗、烧杯;
故答案为:分液漏斗、烧杯;
(3)由流程图,最终得到取MoO3,回收铜、铁、铝,则在浮洗过程将二氧化硅除去,故底泥的主要成分是SiO2;
故答案为:SiO2;
(4)①MoS2发生的反应为2MoS2+9O2+6H2O=2H2MoO4+4H2SO4,该反应中氧化剂为氧气,还原剂为oS2,故氧化剂与还原剂的物质的量之比为9:2;
故答案为:9:2;
②MoO3中氧元素-2价,则Mo的化合价为+6价;将二钼酸铵溶液结晶、煅烧得到MoO3,则MoO3是酸性氧化物;
故答案为:+6;酸性;
(5)高温煅烧二钼酸铵[(NH4)2Mo2O7]的化学方程式为:(NH4)2Mo2O7$\frac{\underline{\;高温\;}}{\;}$2MoO3+2NH3↑+H2O,
故答案为:(NH4)2Mo2O7$\frac{\underline{\;高温\;}}{\;}$2MoO3+2NH3↑+H2O;
(6)若用1×l04 kg辉钼矿(含0.16% MoS2)制取MoO3,该流程中钼元素的损耗率为10%,根据Mo元素质量守恒,则有1×l04×0.16%×90%×$\frac{96}{160}$=m(MoO3)×$\frac{96}{144}$,解得m(MoO3)=1.296×l03 kg;
故答案为:1.296×l03.
点评 本题考查物质制备、化学与技术,涉及对工艺流程的理解、陌生方程式的书写、物质的分离提纯、化学计算等,基本抛弃中学内容,是对学生综合能力的考查,属于易错题目,难度较大.

 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案①二氧化碳分解生成氧气:2CO2(g)═2CO(g)+O2(g);△H1=566kJ•mol-1
②过氧化氢分解生成氧气:2H2O2(l)═2H2O(l)+O2(g);△H2=-196.4kJ•mol-1
③光照条件下,催化分解水蒸气生成氧气:2H2O(g)═2H2(g)+O2(g);△H3=483.6kJ•mol-1.
| A. | 反应①使用催化剂,能降低该反应的活化能 | |
| B. | 反应②为吸热反应 | |
| C. | 反应③将化学能转化为光能 | |
| D. | 反应CO(g)+H2O(g)═CO2(g)+H2(g);△H=-82.4 kJ•mol-1 |
| A. | 油脂是热值最高的营养物质,可以制造肥皂和油漆 | |
| B. | 利用二氧化碳制造全降解塑料,符合绿色化学理念 | |
| C. | 脱脂棉、滤纸、蚕丝的主要成分均为纤维素,完全水解能得到葡萄糖 | |
| D. | 酒精、福尔马林用于杀菌消毒的原理都是使蛋白质变性 |
| A. | 浓氨水 | B. | NaOH溶液 | C. | 盐酸 | D. | CO2和水 |
 将水分解制得氢气的一种工业方法是“硫-碘循环法”,依次涉及下列三步反应:
将水分解制得氢气的一种工业方法是“硫-碘循环法”,依次涉及下列三步反应: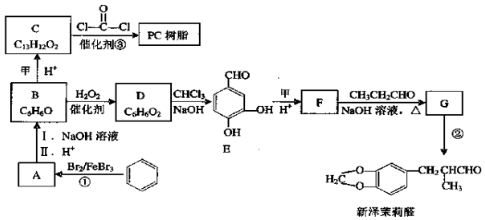
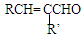 +H2O
+H2O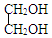 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$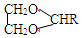 +H2O
+H2O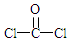 +2ROH$\stackrel{催化剂}{→}$
+2ROH$\stackrel{催化剂}{→}$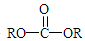 +2HCl
+2HCl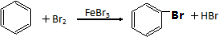 .
. .
. .
. .
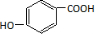
.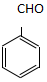 )为原料,选用必要的无机试剂合成
)为原料,选用必要的无机试剂合成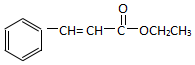 ,写出合成路线
,写出合成路线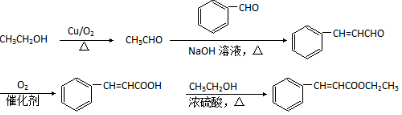 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
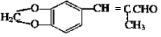
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).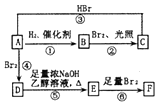 烯烃A在一定条件下可以按下而的流程进行反应.
烯烃A在一定条件下可以按下而的流程进行反应.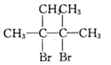
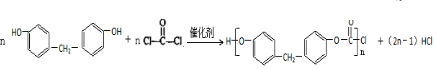
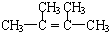 .
.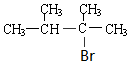 .
.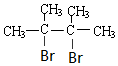 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$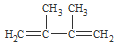 +2NaBr+2H2O.
+2NaBr+2H2O.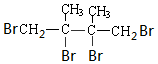 .
.