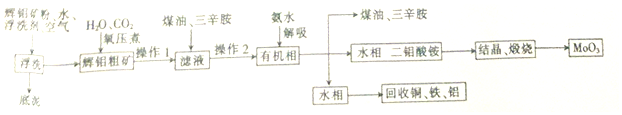
题目内容
16.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(S)+6C(S)+2N2(g)?Si3N4(S)+6CO(g)(1)该反应的平衡常数表达式为K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$;
(2)若知上述反应为放热反应,则其反应热△H<零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值减小(填“增大”、“减小”或“不变”);
(3)若使压强增大,则上述平衡向逆反应方向移动(填“正”或“逆”);若增加一定质量的碳,则上述平衡向不移动反应方向移动(填“正”或“逆”或“不移动”)
(4)若已知CO生成速率为v(CO)=18mol/(L•min),则N2消耗速速率为v(N2)=6mol/(L•min).
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,注意固体、纯液体浓度为常数,不用写固体、纯液体的浓度;
(2)对于放热反应,反应热△H<0;该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;
(3)增大压强平衡向气体体积减小的方向移动;碳是固体,增大碳的用量,不影响反应速率;
(4)根据速率之比等于化学计量数之比计算.
解答 解:(1)可逆反应3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)的平衡常数K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$;
故答案为:$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$;
(2)对于放热反应,反应热△H<0;该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;
故答案为:<;减小;
(3)该反应正反应是气体体积增大的反应,增大压强平衡向气体体积减小的方向移动,即向逆反应移动;
碳是固体,增大碳的用量,不影响反应速率,平衡不移动;
故答案为:逆;不移动;
(4)已知CO生成速率为v(CO)=18mol/(L•min),根据速率之比等于化学计量数之比,则N2消耗速率为v(N2)=$\frac{1}{3}$v(CO)=$\frac{1}{3}$×18mol/(L•min)=6mol/(L•min);
故答案为:6mol/(L•min).
点评 本题考查化学平衡常数与影响因素、影响平衡移动的因素、化学反应速率计算等,比较基础,注意方程式中物质的状态,注意基础知识的掌握.

练习册系列答案
相关题目
4.碳与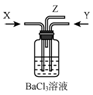 浓硫酸共热产生的气体X和铜和浓硝酸反应产生的气体Y间时通入盛有足量氯化钡溶液的气瓶中(如图装置),下列有关说法不正确的是( )
浓硫酸共热产生的气体X和铜和浓硝酸反应产生的气体Y间时通入盛有足量氯化钡溶液的气瓶中(如图装置),下列有关说法不正确的是( )
 浓硫酸共热产生的气体X和铜和浓硝酸反应产生的气体Y间时通入盛有足量氯化钡溶液的气瓶中(如图装置),下列有关说法不正确的是( )
浓硫酸共热产生的气体X和铜和浓硝酸反应产生的气体Y间时通入盛有足量氯化钡溶液的气瓶中(如图装置),下列有关说法不正确的是( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | B. | 洗气瓶中产生的沉淀是亚硫酸钡 | ||
| C. | 洗气瓶中有氧化还原反应发生 | D. | 在Z导管口有红棕色气体出现 |
11.红色物质甲在空气中加热生成黑色物质乙,甲也能溶于浓硝酸放出红色气体丙,并得到溶质为丁的蓝色溶液.下列推断中正确的是( )
| A. | 甲为铁锈 | B. | 乙为FeO | C. | 丙为NO2 | D. | 丁为CuCl2 |
1.由乙醇制取乙二酸乙二酯时,最简便的流程需要下列哪些反应,其正确的顺序是( )
①水解;②加成;③氧化;④还原;⑤消去;⑥酯化;⑦中和.
①水解;②加成;③氧化;④还原;⑤消去;⑥酯化;⑦中和.
| A. | ①②③⑤⑦ | B. | ⑤②①③⑥ | C. | ⑤②①④⑦ | D. | ①②⑤③⑥ |
8.下列说法不正确的是( )
| A. | 烷烃的同系物可用通式CnH2n+2表示 | |
| B. | 同系物的化学性质相似 | |
| C. | 同系物的物理性质相同 | |
| D. | 同分异构体的化学性质一定不相似 |
5.X、Y、Z、W、M均为短周期元素.其中,X、Y同主族,Y元素形成的一种单质可保存在冷水中;Z、W、Y、M是第三周期连续的四种元素,原子半径依次减小.下列叙述不正确的是( )
| A. | X的液态单质可在医疗上用于冷冻麻醉 | |
| B. | Y、M两元素气态氢化物的稳定性:Y<M | |
| C. | 工业上制备Z的单质可电解其熔融态的氧化物 | |
| D. | 氧化物XO2与MO2均具有漂白性,且漂白原理相同 |
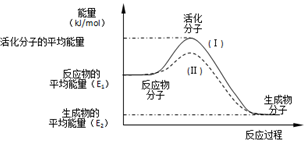 在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.
在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题.