题目内容
17.下列实验能达到目的是( )| A. | 用50mL量筒量取2.35mL稀硫酸 | |
| B. | 用托盘天平称5.56gKCl固体 | |
| C. | 配制100mlL浓度为1 mol/L的食盐水需称食盐5.9g | |
| D. | 用酒精可以萃取碘水中的碘 |
分析 A.量筒的感量为0.1mL,且液体体积与量筒规格要接近;
B.托盘天平的感量为0.1g;
C.结合m=cVM计算;
D.酒精与水互溶.
解答 解:A.量筒的感量为0.1mL,且液体体积与量筒规格要接近,则选10mL量筒量取2.3mL稀硫酸,故A错误;
B.托盘天平的感量为0.1g,则用托盘天平称5.6gKCl固体,故B错误;
C.配制100mlL浓度为1 mol/L的食盐水需称食盐为0.1L×1mol/L×58.5g/mol≈5.9g,故C正确;
D.酒精与水互溶,不能作萃取剂,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的使用、混合物分离提纯、溶液配制为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
7.四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-═Fe3O4↓+S4O62-+2H2O.下列说法不正确的是( )
| A. | 参加反应的氧化剂与还原剂的物质的量之比为1:5 | |
| B. | 若有2 mol Fe2+被氧化,则被Fe2+还原的O2的物质的量为0.5 mol | |
| C. | 每生成1 mol Fe3O4,反应转移的电子为4 mol | |
| D. | O2是氧化剂,S2O32-与Fe2+是还原剂 |
8.下列物质中,能够导电的电解质是( )
| A. | 铜丝 | B. | 熔融的MgCl2 | C. | NaCl溶液 | D. | 乙醇 |
5.一定条件下存在反应:H2(g)+I2(g)?2HI(g)△H<0,现有三个相同的体积均为 1L 的恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入 1mol H2和 1molI2(g),在Ⅱ中充入 2molHI(g),在Ⅲ中充入 2mol H2和2mol I2(g),700℃条件下开 始反应.达到平衡时,下列说法正确的是( )
| A. | 容器Ⅰ、Ⅱ中正反应速率相同 | |
| B. | 容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数 | |
| C. | 容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色深 | |
| D. | 容器Ⅰ中 H2的转化率与容器Ⅱ中HI的转化率之和等于1 |
12.在某一温度条件下,Bodensteins 研究了反应:2HI(g)?H2(g)+I2(g),气体 混合物中 HI 的物质的量分数 x(HI)与反应时间 t 的关系如表:
(1)根据上述实验结果,该反应的平衡常数 K 的计算式为$\frac{0.108×0.108}{078{4}^{2}}$.
(2)上述反应,正反应速率为 v 正=k 正 x2(HI),逆反应速率为 v 逆=k 逆 x(H2)x(I2),其中 k 正k 逆为速率常数,则 k 逆为$\frac{{K}_{正}}{K}$(以 K 和 k 正表示).若 k 正=0.002 min,第一次试验时,v(正)=1.95×10-3min.
| t/min | 0 | 20 | 40 | 60 | 80 | 120 | |
| 第一次试验 | x(HI) | 1 | 0.90 | 0.85 | 0.815 | 0.795 | 0.784 |
| 第二次试验 | x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
(2)上述反应,正反应速率为 v 正=k 正 x2(HI),逆反应速率为 v 逆=k 逆 x(H2)x(I2),其中 k 正k 逆为速率常数,则 k 逆为$\frac{{K}_{正}}{K}$(以 K 和 k 正表示).若 k 正=0.002 min,第一次试验时,v(正)=1.95×10-3min.
2.若某氖原子一个原子质量是a g,NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | 氖元素的相对原子质量是a | |
| B. | 该氖原子的摩尔质量是aNAg | |
| C. | Wg该氖原子的物质的量一定是$\frac{W}{{a{N_A}}}$mol | |
| D. | Wg该氖气的体积是22.4$\frac{W}{{a{N_A}}}$升 |
7.等物质的量H2O、H2SO4和CH4,其质量关系是( )
| A. | H2SO4>H2O>CH4 | B. | CH4>H2O>H2SO4 | C. | H2O>H2SO4>CH4 | D. | H2SO4>CH4>H2O |

 .
. ,D
,D ,E
,E ,H
,H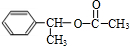 .
. +NaBr.
+NaBr.