题目内容
7.四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-═Fe3O4↓+S4O62-+2H2O.下列说法不正确的是( )| A. | 参加反应的氧化剂与还原剂的物质的量之比为1:5 | |
| B. | 若有2 mol Fe2+被氧化,则被Fe2+还原的O2的物质的量为0.5 mol | |
| C. | 每生成1 mol Fe3O4,反应转移的电子为4 mol | |
| D. | O2是氧化剂,S2O32-与Fe2+是还原剂 |
分析 从电荷守恒的角度分析,可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,反应中Fe和S元素的化合价升高,被氧化,O2为氧化剂,以此解答该题.
解答 解:A.参加反应的氧化剂与还原剂的物质的量之比为1:(2+2)=1:4,故A错误;
B.1molFe2+被氧化时,失去1mol电子,则被Fe2+还原的O2的物质的量为$\frac{1}{4}$mol,所以有2 mol Fe2+被氧化,则被Fe2+还原的O2的物质的量为0.5 mol,故B正确;
C.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,故C正确;
D.S2O32-→S4O62-,S元素的化合价升高,S2O32-和部分的Fe2+是还原剂,氧气是氧化剂,故D正确.
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子守恒计算的考查,题目难度不大.

练习册系列答案
相关题目
17. 金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
 金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )| A. | 绿原酸的分子式为C16H8O9 | |
| B. | 1mol绿原酸最多与7mol NaOH反应 | |
| C. | 绿原酸是芳香族化合物 | |
| D. | 绿原酸分子中有4种化学环境不同的氢原子 |
18.某微粒的核外L层电子的数目为8个,M层8个,该微粒一定是( )
| A. | 原子 | B. | 阴离子 | C. | 阳离子 | D. | 无法确定 |
15.图是某儿童微量元素体检报告单的部分数据:
根据上表的数据,回答下列问题:
(1)该儿童铁(或Fe)元素含量偏低.
(2)报告单中“μmol/L”是浓度(填“质量”、“体积”或“浓度”)的单位.
(3)服用维生素C可使食物中的Fe3+转化为Fe2+.在这个过程中维生素C表现出
还原性(填“氧化性”或“还原性”).
(4)硫酸亚铁晶体(FeSO4•7H2O)在医疗上可作补血剂.某课外小组测定该补血剂(每片b克)中铁元素的含量.实验步骤如图:
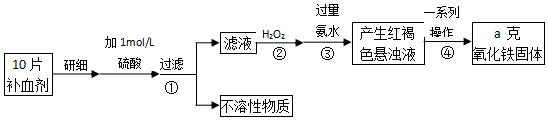
请回答下列问题:
a.②中H2O2的作用是将Fe2+全部氧化为Fe3+.
b.④中一系列处理的操作步骤为 过滤、洗涤、灼烧、冷却、称量.
c.若实验无损耗,则每片补血剂含铁元素的质量分数为$\frac{7a}{b}%$.
d.下列操作会导致所测定的铁元素含量偏高的是BC
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分.
| 怀化市医疗机构临床检验结果报告单 | ||||
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | 锌(Zn) | 115.92 | μmol/L | 66-120 |
| 2 | 铁(Fe) | 6.95↓ | mmol/L | 7.52-11.82 |
| 3 | 钙(Ca) | 1.68 | mmol/L | 1.55-2.10 |
| … | ||||
(1)该儿童铁(或Fe)元素含量偏低.
(2)报告单中“μmol/L”是浓度(填“质量”、“体积”或“浓度”)的单位.
(3)服用维生素C可使食物中的Fe3+转化为Fe2+.在这个过程中维生素C表现出
还原性(填“氧化性”或“还原性”).
(4)硫酸亚铁晶体(FeSO4•7H2O)在医疗上可作补血剂.某课外小组测定该补血剂(每片b克)中铁元素的含量.实验步骤如图:

请回答下列问题:
a.②中H2O2的作用是将Fe2+全部氧化为Fe3+.
b.④中一系列处理的操作步骤为 过滤、洗涤、灼烧、冷却、称量.
c.若实验无损耗,则每片补血剂含铁元素的质量分数为$\frac{7a}{b}%$.
d.下列操作会导致所测定的铁元素含量偏高的是BC
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分.
2.下列叙述不正确的是( )
| A. | 用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小 | |
| B. | 用反应热数据的大小判断不同反应反应速率的快慢 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 用平衡常数的大小判断化学反应可能进行的程度 |
12.下列关于化石燃料的加工说法正确的( )
| A. | 石油裂化主要得到乙烯 | |
| B. | 石油分馏在分馏塔中进行,是化学变化,可得到汽油、煤油 | |
| C. | 煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气等 | |
| D. | 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 |
17.下列实验能达到目的是( )
| A. | 用50mL量筒量取2.35mL稀硫酸 | |
| B. | 用托盘天平称5.56gKCl固体 | |
| C. | 配制100mlL浓度为1 mol/L的食盐水需称食盐5.9g | |
| D. | 用酒精可以萃取碘水中的碘 |