题目内容
6.将32.64g Cu与200mL一定浓度的HNO3反应,Cu完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.(1)求生成NO的物质的量;
(2)求生成NO2的体积.
分析 n(Cu)=$\frac{32.64g}{64g/mol}$=0.51mol,Cu完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L,气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,反应中Cu元素的化合价升高,N元素的化合价降低,结合原子及电子守恒计算.
解答 解:n(Cu)=$\frac{32.64g}{64g/mol}$=0.51mol,气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
设NO和NO2的物质的量分别为x、y,
由电子、原子守恒可知,
$\left\{\begin{array}{l}{x+y=0.5}\\{3x+y=0.51×2}\end{array}\right.$
解得x=0.26mol,y=0.24mol,
(1)由上述分析可知,生成NO的物质的量为0.26mol,
答:生成NO的物质的量为0.26mol;
(2)生成NO2的体积为0.24mol×22.4L/mol=5.376L,
答:生成NO2的体积为5.376L.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化、电子和原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
相关题目
17.下列实验能达到目的是( )
| A. | 用50mL量筒量取2.35mL稀硫酸 | |
| B. | 用托盘天平称5.56gKCl固体 | |
| C. | 配制100mlL浓度为1 mol/L的食盐水需称食盐5.9g | |
| D. | 用酒精可以萃取碘水中的碘 |
14.25℃时,将a g硫酸铜晶体(CuSO4•5H2O)溶于b g水中,恰好形成V mL饱和溶液.下列关系不正确的是( )
| A. | 该饱和溶液硫酸铜物质的量浓度为c=$\frac{4a}{v}$ mol•L-1 | |
| B. | 该饱和溶液中硫酸铜的质量分数为w=$\frac{16a}{a+b}$% | |
| C. | 25℃硫酸铜的溶解度为 S=$\frac{1600a}{9a+25b}$g | |
| D. | 该饱和硫酸铜溶液的密度为ρ=$\frac{a+b}{v}$g•L-1 |
1.经研究发现白蚁信息素有: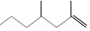 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯),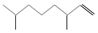 (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )
 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯), (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )| A. | 2,4-二甲基1庚烯的分子式为C9H18 | |
| B. | 2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同系物 | |
| C. | 以上三种信息素均能使溴的四氯化碳溶液褪色 | |
| D. | 1 mol家蚕的性信息素与1 mol Br2加成,产物只有一种 |
11.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 比较水和乙醇中氢的活泼性 | 分别讲少量钠投入到盛有水和乙醇的烧杯中 |
| B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和的FeCl3溶液中 |
| A. | A | B. | B | C. | C | D. | D |
18.下列溶液中的c(Cl-)与50ml 1mol/L AlCl3溶液中c(Cl-)相等的是( )
| A. | 150mL 1mol/L氯化钠溶液 | B. | 75mL2mol/L氯化钙溶液 | ||
| C. | 150mL 3mol/L氯化钾溶液 | D. | 75mL1mol/L氯化铜溶液 |
15.某广告称某种牌号的八宝粥(含桂圆、红豆、糯米等)不加糖,比加糖还甜,最适合糖尿病人食用.你认为下列关于糖尿病人能否食用此八宝粥的判断正确的是( )
| A. | 这个广告有误导喜爱甜食的消费者的嫌疑,不加糖不等于没有糖 | |
| B. | 不加糖不等于没有糖,糖尿病人食用需慎重 | |
| C. | 不能只听从厂商或广告商的宣传,应咨询医生 | |
| D. | 糖尿病人应少吃含糖的食品.该八宝粥未加糖,可以放心食用 |
16.下列溶液中的Cl-浓度与50mL1mol•L-1MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150mL1mol•L-1NaCl溶液 | B. | 75mL1mol•L-1CaCl2溶液 | ||
| C. | 150mL1mol•L-1KCl溶液 | D. | 75mL1mol•L-1AlCl3溶液 |