题目内容
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1mol N2所含有的原子数为NA |
| B、24g O2分子和24g O3分子所含的氧原子数目相等 |
| C、标准状况下,22.4L氯化氢所含的原子数为NA |
| D、在标准状况下,NA个任何分子所占的体积约为22.4L |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氮气为双原子分子,1mol氮气中含有2mol氮原子;
B.24g氧气和24g臭氧中都含有24gO原子,含有1.5mol氧原子;
C.氯化氢为双原子分子,标况下22.4L氯化氢的物质的量为1mol,含有2mol原子;
D.标准状况下,必须是1mol气体所占的体积约为22.4L.
B.24g氧气和24g臭氧中都含有24gO原子,含有1.5mol氧原子;
C.氯化氢为双原子分子,标况下22.4L氯化氢的物质的量为1mol,含有2mol原子;
D.标准状况下,必须是1mol气体所占的体积约为22.4L.
解答:
解:A.1mol氮气分子中含有2mol氮原子,所含有的原子数为2NA,故A错误;
B.24g氧气和24g臭氧中都含有24g氧原子,24g氧原子的物质的量为1.5mol,所以二者含有的氧原子数目相同,故B正确;
C.标况下22.4L氯化氢的物质的量为1mol,1mol氯化氢中含有2mol原子,所含的原子数为2NA,故C错误;
D.NA个任何分子的物质的量为1mol,标准状况下,物质的状态必须是气体,1mol该物质的体积才约占22.4L,故D错误;
故选B.
B.24g氧气和24g臭氧中都含有24g氧原子,24g氧原子的物质的量为1.5mol,所以二者含有的氧原子数目相同,故B正确;
C.标况下22.4L氯化氢的物质的量为1mol,1mol氯化氢中含有2mol原子,所含的原子数为2NA,故C错误;
D.NA个任何分子的物质的量为1mol,标准状况下,物质的状态必须是气体,1mol该物质的体积才约占22.4L,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件;掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A、含1mol Fe(OH)3的胶体中的胶体粒子数目为NA |
| B、1mol氯气与足量的氢氧化钠反应电子转移总数为2NA |
| C、常温下,23g NO2和N2O4的混合气体中含有NA个氧原子 |
| D、11.2L CO2与8.5g NH3所含的分子数相等 |
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,1mol CO2和CO的混合气中含有的氧原子数为1.5NA |
| B、常温常压下,11.2L氯化氢气体中含有的分子数为0.5NA |
| C、12g Mg与足量二氧化碳反应转移的电子数为NA |
| D、1mol?L-1 CuCl2溶液中含有的氯离子数为2NA |
设阿伏加德罗常数为NA,则下列说法正确的是( )
| A、常温常压下,11.2L甲烷中含有的氢原子数为2NA |
| B、标准状况下,22.4L CCl4中含有的氯原子数为4NA |
| C、常温常压下,7.8g Na2O2与CO2完全反应转移电子数为0.1NA |
| D、通常状况下,2.7g Al与足量的稀盐酸反应,生成H2的分子数为0.3NA |
下列反应中,属于氧化还原反应的是( )
A、2H2O2
| ||||
B、2Al(OH)3
| ||||
| C、FeO+2HCl=FeCl2+H2O | ||||
| D、FeCl2+2NaOH=Fe(OH)2↓+2NaCl |
用于解释下列现象的化学用语表述正确的是( )
| A、硫化钠溶液呈碱性:S2-+2H2O?H2S+2OH- |
| B、亚硫酸溶液呈酸性:H2SO3═2H++SO32- |
| C、氯化铝溶液跟过量的氨水反应:Al3++4OH-═[Al(OH)4]- |
| D、FeCl3溶液呈酸性:Fe3++3H2O?Fe(OH)3+3H+ |

 它可通过不同化学反应分别制得B、C、D和E四种物质.
它可通过不同化学反应分别制得B、C、D和E四种物质.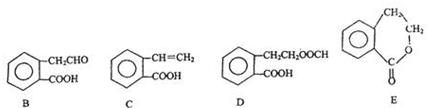
 、HCOOH、CH3COOC2H5
、HCOOH、CH3COOC2H5 原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+ 离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答:
原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+ 离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答: